Kovalent binding

Ikkje-metall kan binde seg til kvarandre ved at områda der elektrona bevegar seg, overlappar kvarandre. Slik kan atoma dele på elektron og samstundes oppnå åtte elektron i det ytste elektronskalet sitt.
Kvar av dei positive kjernane trekkjer det felles elektronparet mot seg, slik at atoma held saman. Vi seier at det er ei kjemisk binding mellom atoma.
Kovalente bindingar kan illustrerast på fleire måtar:
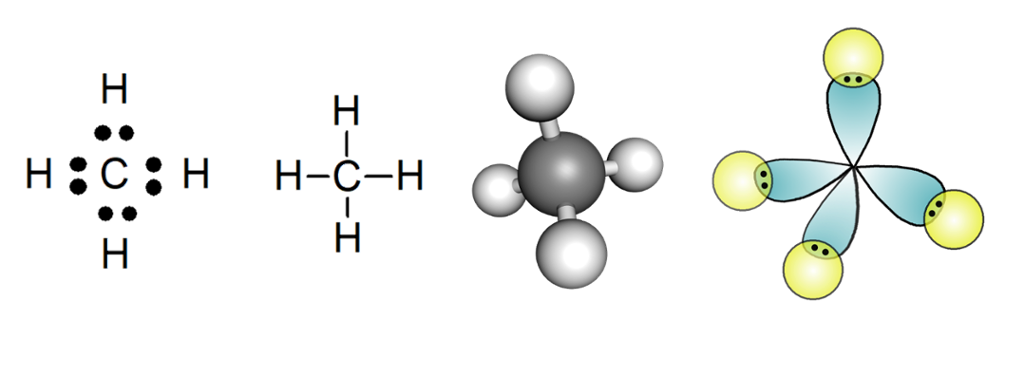
I ein elektronprikkstruktur bruker vi grunnstoffsymbola og illustrerer dei delte elektrona med prikkar. I ein strekformel teiknar vi strekar i staden for prikkar. Kule-pinnemodellar gir eit godt bilete av geometrien til eit molekyl. Ein orbitalmodell viser korleis elektronskyene til atoma i molekylet overlappar og dannar kovalente bindingar.
Viss atoma som blir haldne saman av kovalent binding er av same type, blir dei felles elektrona delt likt mellom atoma. Det gjeld til dømes i hydrogengass, som består av to hydrogenatom, .
Når atom av ulike typar bind seg saman, vil dei trekkje dei felles elektrona til seg i ulik grad.
I HCl-molekylet vil klor trekkje elektrona nærare seg enn det hydrogen vil gjere. Det er fordi klor er ein meir elektronegativ atomtype enn hydrogen.
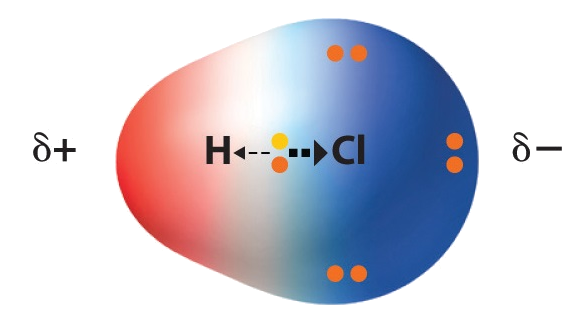
Bindinga mellom hydrogen og klor blir kalla ei polar kovalent binding. Jo større forskjell det er på elektronegativiteten mellom atoma som er bundne saman, jo større grad av ionekarakter har bindinga.
Legg merke til at det ikkje er noko klart skilje mellom rein kovalent binding, polar kovalent binding og ionebinding.
Til tross for dette set ein gjerne opp nokre grenser for dei ulike bindingstypane, basert på forskjellen i elektronegativitetsverdiene til atoma.