Syrer og basar
I siste del av førre hundreåret begynte ein å søkje etter forklaringar på kva syrer og basar eigentleg er. Kva er likt hos alle syrer? Og kva er likt hos alle basar? Kva er det som avgjer om eit stoff skal bli ei syre eller ein base?
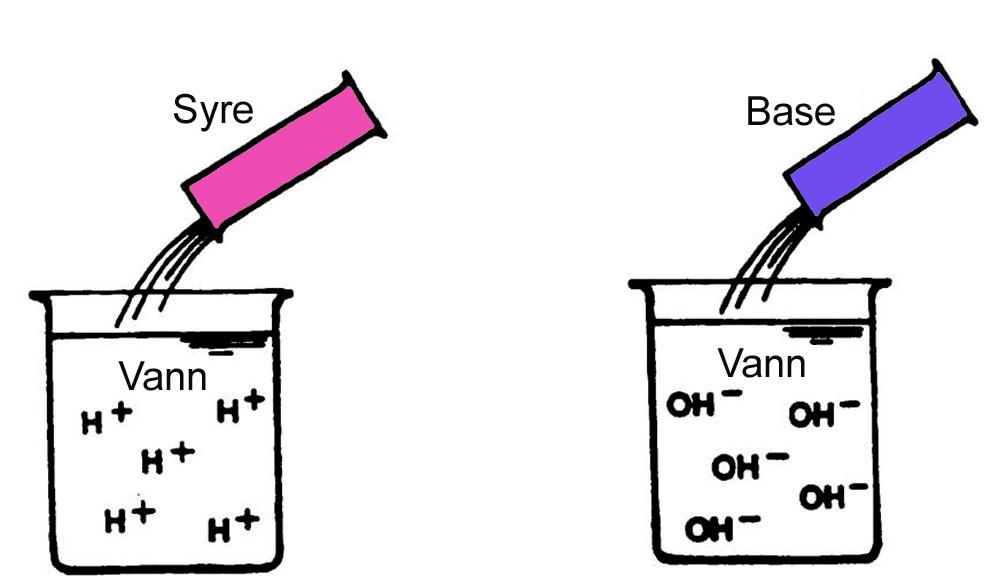
Ei syre er eit stoff som kan gi frå seg proton (H+) i vatn, altså ein protongivar!
Ein base er eit stoff som kan ta opp proton (H+) i vatn, altså ein protonmottakar, eller eit stoff som kan gi frå seg OH–-ion i vatn!
Mange av syrene har vore kjende så lenge at bestemte namn frå daglegtalen blir brukte. Men vi skriv alltid syreformlane på same måten, med hydrogen først.
Dei best kjende av syrene er:
- Saltsyre: HCl (einverdig syre eller einprotisk)
- Salpetersyre: HNO3 (einverdig syre eller einprotisk syre)
Det som er forskjellig for alle syrer, og som derfor på ein eller annan måte gir syra namn, er syreresten. Syreresten er den delen av syra som er igjen når hydrogenet (a) er teke bort.
For eksempel er syreresten til saltsyre kloridionet (Cl-). Syreresten til svovelsyre er sulfationet (SO42-) og så vidare. At syrerestane er negative ion, kjem av at når hydrogenatomet blir spalta av frå syra, har det forma H+, elektronet blir igjen på syreresten.
Hydroksid er eit stoff som har OH–-ion i formelen. Når slike hydroksid kjem i vatn, blir OH−-iona spalta av og dannar basar. Mange av dei viktigaste basane vi skal lære om, er nettopp hydroksid løyst i vatn. Her er nokre:
- Natronlut = vassløysning av natriumhydroksid = NaOH
- Kalilut = vassløysning av kaliumhydroksid = KOH
- Kalkvatn = vassløysning av kalsiumhydroksid = Ca(OH)2
Ammoniakk NH3 er òg ein base, for når NH3 blir løyst i vatn, blir det danna OH–-ion i vatnet akkurat som for dei andre basane.
NH3 + H2O → NH4+ + OH-
Syrer og basar er etsande væsker. Søler vi på kleda, blir det hòl i stoffet. På huda kan det bli stygge brannsår. Skyl straks med store mengder vatn. Ved sprut i auga − skyl med vatn, og kontakt leg så hurtig som mogleg!