Kjemiske bindingar
Ei kjemisk binding kan skje på mange måtar. Éi moglegheit er at eitt eller fleire elektron i det ytste elektronskalet blir trekt ut i området mellom to atom, slik at elektrona blir «delte» mellom dei to atoma. Dette blir kalla ei kovalent binding.
Atom kan òg bli haldne saman på andre måtar, for eksempel gjennom ionebindingar eller metallbindingar. Vi skal her sjå nærmare på alle desse tre bindingstypane.
Gassen metan er sett saman av grunnstoffa hydrogen (H) og karbon (C). Vi veit at hydrogen har eitt elektron, og frå periodesystemet kan vi sjå at karbon har fire elektron i det ytste elektronskalet (karbon tilhøyrer gruppe 14).
Hydrogen vil alltid prøve å skaffe seg eitt ekstra elektron slik at det får to elektron i elektronskalet sitt. Då er dette skalet fullt. Alle andre atom vil prøve å få åtte elektron i det ytste skalet. Sidan karbon har fire elektron frå før, vil det altså gjerne ha fire ekstra.
Viss fire hydrogenatom deler elektrona sine med eitt karbonatom, vil heile reknestykket gå opp! Kvart av hydrogenatoma får to elektron i det ytste skalet, og karbonatomet får åtte elektron i sitt ytste skal.
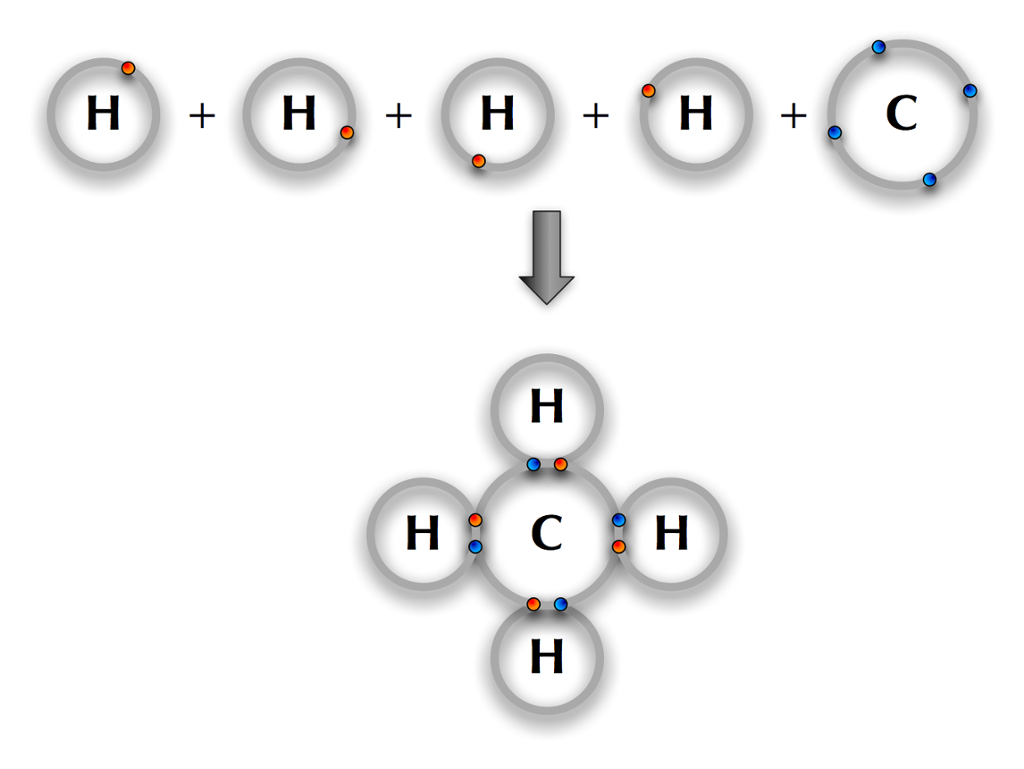
Atom vil prøve å skaffe seg åtte elektron i det ytste skalet ved å lage bindingar med andre atom. Dette kallar vi åtteregelen.
Åtteregelen er veldig viktig og vil hjelpe deg å forstå korleis grunnstoff kan danne molekyl. I kjemien er det elektrona i det ytste elektronskalet til eit atom som er viktige. Kjernepartiklane (proton og nøytron) treng vi ikkje å bry oss om her.
Elektrona i det ytste skalet til eit atom kallar vi valenselektron. Desse elektrona betyr mykje for kva kjemiske sambindingar atomet kan gå inn i.
La oss sjå nærmare på korleis dette går føre seg i vatn. Oksygen har seks valenselektron og manglar altså to elektron for å oppfylle åtteregelen. Oksygenet kan oppfylle regelen ved å dele elektron med to hydrogenatom.
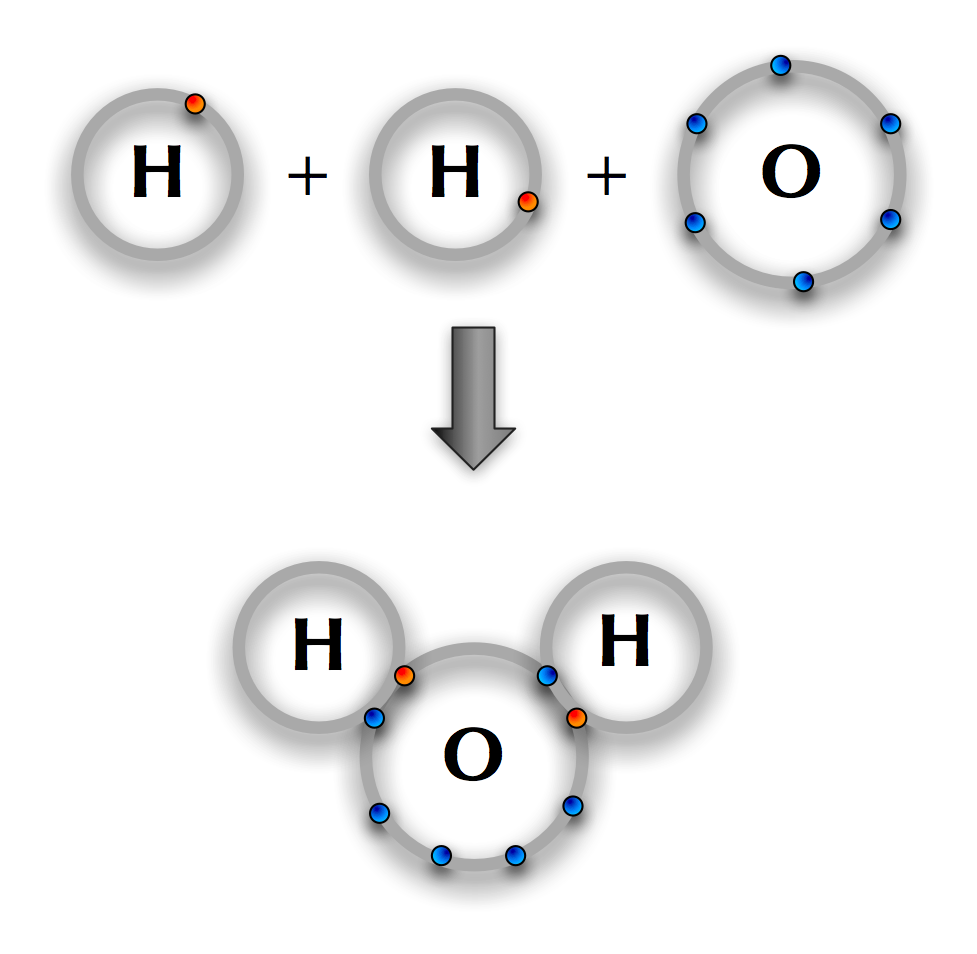
Bindinga mellom hydrogen og vatn er litt spesiell. Det er nemleg slik at elektrona som blir delte, hamnar litt nærmare oksygenatomet enn hydrogenatomet. Sidan elektron har negativ ladning, vil vassmolekylet derfor bli litt negativt ladd ved oksygenatomet. Ved hydrogenatoma vil det vere svakt positivt ladd. Slike bindingar seier vi er polare kovalente.
I figuren over ser du at hydrogenatoma og oksygenatomet ikkje er stilte opp langs ei rett linje, men at dei har hamna i ein vinkel til kvarandre. Årsaka til dette er den vesle «skeivfordelinga» av elektron.
Somme grunnstoff kan gi frå seg eitt eller fleire elektron fullstendig. Då blir det færre elektron enn proton, og atomet blir positivt ladd. Andre grunnstoff kan ta til seg eitt eller fleire elektron. Då blir det fleire elektron enn proton, og atomet blir negativt ladd.
Eit ion er eit ladd atom. Ladningen kjem av at atom gir frå seg eller tek til seg elektron.
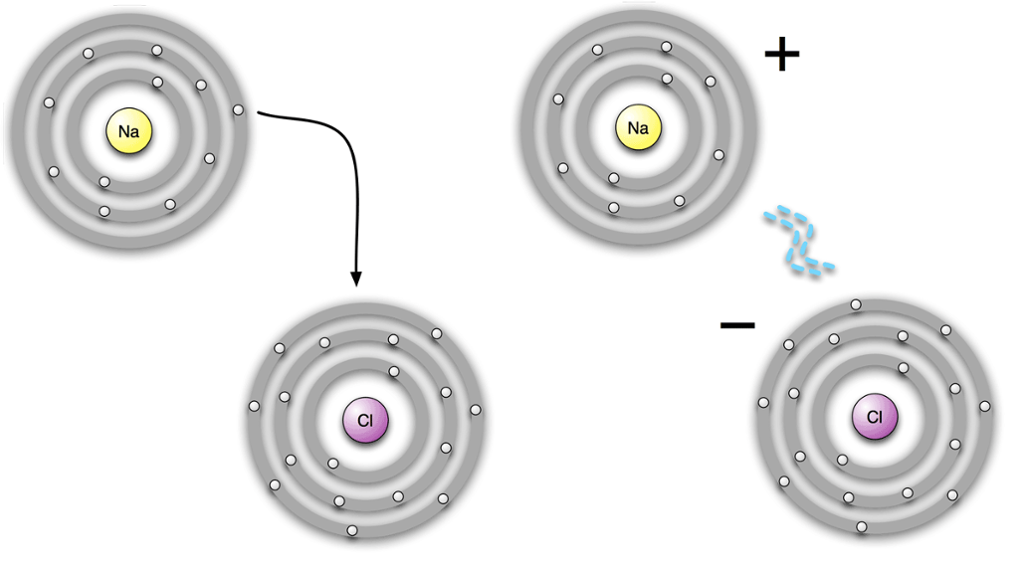
Atom med ulik elektrisk ladning (positiv og negativ) vil trekkje kvarandre til seg. På denne måten får vi det vi kallar ionebindingar. Eit eksempel på ei ionebinding er natriumklorid (NaCl).
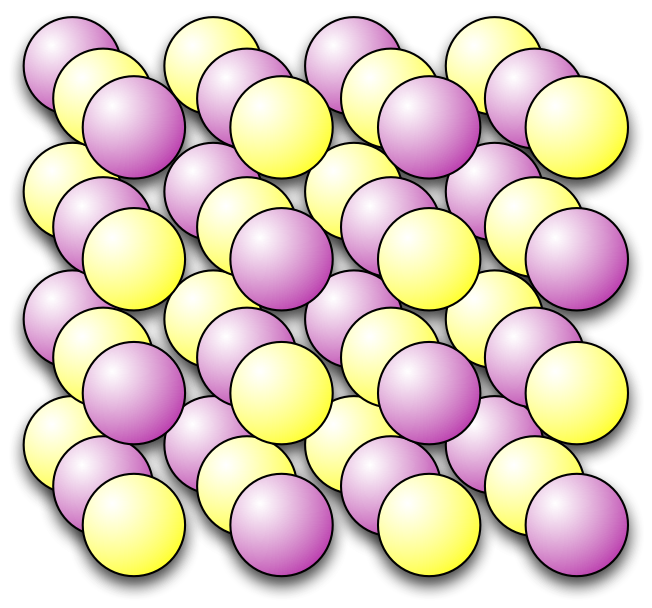
Forskjellen i ladning gjer at atoma blir trekte mot kvarandre og blir organiserte parvis i negativ og positiv rekkjefølgje i ein kubestruktur. Dette kallar vi ein ionisk krystall.
Ionebindingar skjer vanlegvis mellom eit grunnstoff som er eit metall, og eit grunnstoff som ikkje er eit metall. I vårt eksempel er natrium eit metall, og klor er ikkje eit metall. Ved ionebindingar er det alltid metallet som gir frå seg sine valenselektron, og desse blir tekne opp av ikkje-metallet.
Dei aller fleste grunnstoffa er metall. Når dei er i rein form, blir atoma haldne saman med det som blir kalla metallbinding. På same måten som for ionebindingar gir atoma frå seg valenselektrona. Men sidan metallet no er i rein form, finst det ikkje nokon andre atom som kan ta opp desse elektrona. Dermed blir det liggjande ei «sky» av elektron mellom metallatoma. Dette gjer at metall er gode til å leie elektrisk straum.

Valenselektrona til kvart enkelt atom blir no «felles» for alle dei andre atoma i metallbindinga.
I metallbindingar blir «frie» elektron delte mellom fleire metallatom.
Metallbindingar er sterke, og det skal mykje til for å bryte dei opp. Grunnstoffet wolfram (W) har eit kokepunkt på heile 5555 °C!