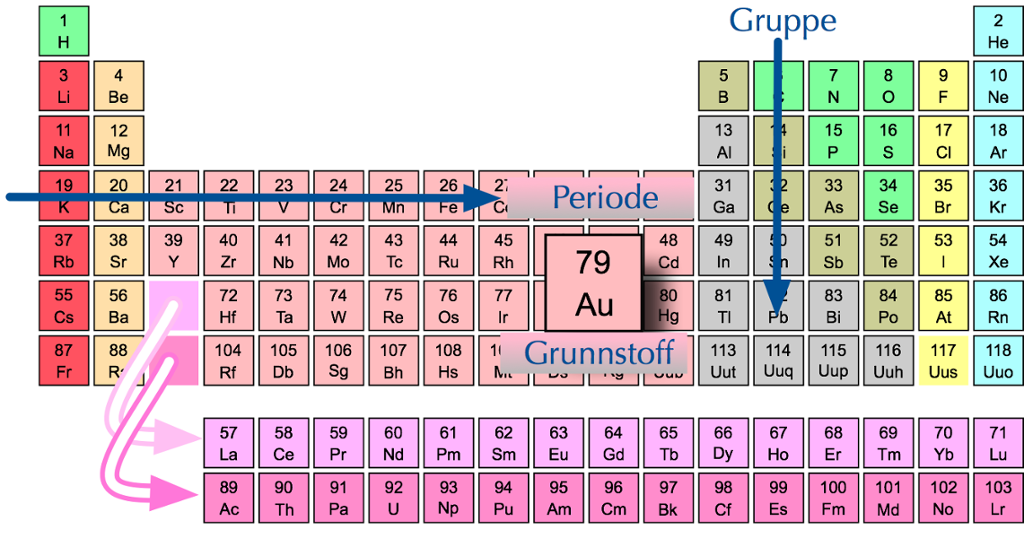
Periodesystemet
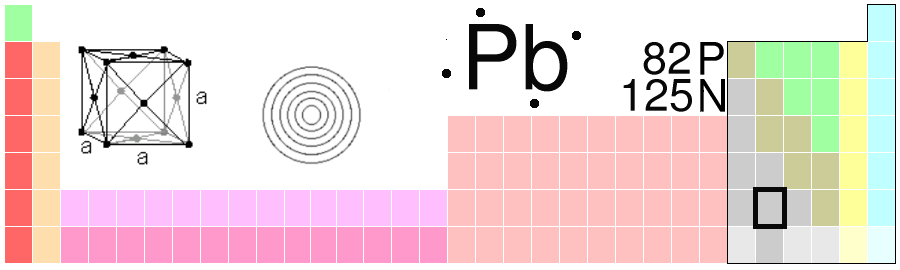
For eksempel har hydrogen atomnummer 1, helium har atomnummer 2, og så vidare. I tillegg har alle grunnstoff eit namn og eit kjemisk symbol. Symbolet består av éin eller to bokstavar og er det same på alle språk i verda. Slik er det ikkje med namna til grunnstoffa. For eksempel heiter det “bly” på norsk, mens det heiter “lead” på engelsk. Det kjemiske symbolet derimot er det same på begge språk: Pb. Vi kan seie at vi har eit eige “kjemispråk”.
Alle grunnstoff har eit kjemisk symbol som består av éin eller to bokstavar. I motsetning til namnet på stoffet er symbolet stoffet har, felles på alle språk.
Alle grunnstoffa kan vi ordne på ein oversiktleg måte i ein tabell som vi kallar periodesystemet. Vi startar øvst til venstre og stiller grunnstoffa opp etter stigande atomnummer.
I periodesystemet er grunnstoffa ordna etter stigande atomnummer.
Radene i periodesystemet kallar vi periodar. I den første perioden finn vi hydrogen (H) og helium (He). Desse grunnstoffa har berre eitt elektronskal.
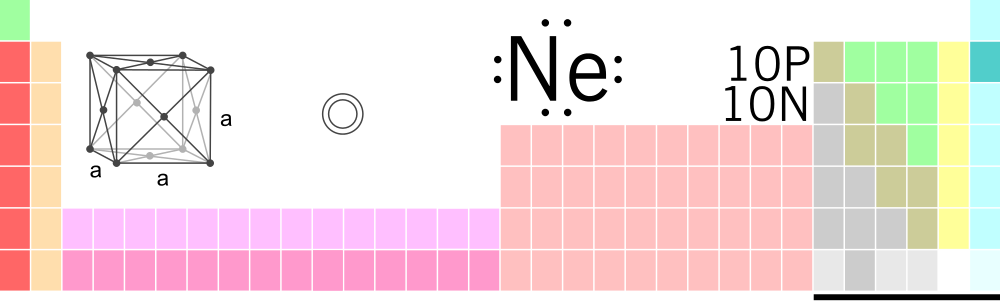
I den andre perioden finn vi alle grunnstoffa med to elektronskal. Desse grunnstoffa har plass til 10 elektron – 2 i det inste skalet og 8 i det ytste skalet. Grunnstoffet neon (Ne) har ti proton og ti elektron. To av elektrona er i det inste skalet, og då må det vere åtte elektron i det neste skalet.
Grunnstoffet natrium (Na) har elleve proton og elleve elektron. Det har to elektron i det inste skalet og åtte elektron i det neste skalet. Sidan det ikkje er plass til fleire i det andre skalet, får det siste elektronet plass i eit tredje skal. I den tredje perioden finn vi alle grunnstoffa med tre elektronskal. Slik held det fram nedover i periodane.
I periodesystemet blir grunnstoffa delte inn i periodar etter kor mange elektronskal dei har.

I 1869 laga den russiske kjemiprofessoren Dmitrij Ivanovitsj Mendelejev det første utkastet til periodesystemet. Han organiserte grunnstoffa etter atomvekt og kjemiske eigenskapar.
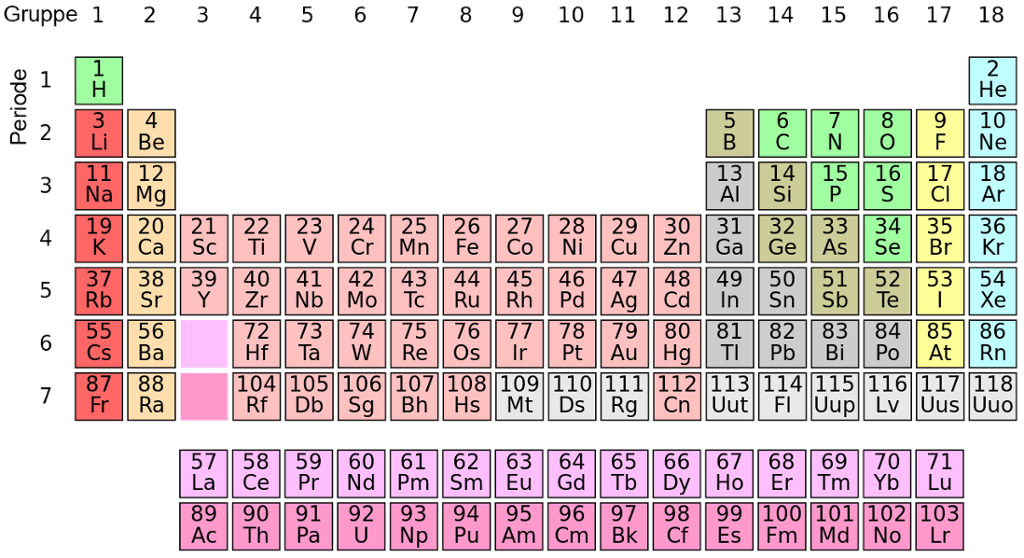
Grunnstoffa blei opphavleg ordna i kolonnar avhengig av dei kjemiske eigenskapane stoffa hadde. Det vil seie at dei grunnstoffa som er i same kolonne, liknar litt på kvarandre i måten dei reagerer med andre stoff på. Dette heng nøye saman med kor mange elektron eit grunnstoff har i det ytste skalet.
Grunnstoffa hydrogen (H), litium (Li) og natrium (Na) har eitt elektron i det ytste elektronskalet. Derfor plasserer vi desse i den første kolonnen. Denne kolonnen kallar vi gruppe 1.
Den neste kolonnen inneheld grunnstoff med to elektron i det ytste skalet, og denne kallar vi gruppe 2. Grunnstoffa i gruppe 3–12 har eitt eller to elektron i det ytste skalet. I gruppe 13 har alle grunnstoffa tre elektron i det ytste skalet, og i gruppe 14 har alle grunnstoffa fire elektron i det ytste skalet.
Slik held det fram bortover i gruppene. I gruppe 18 (den siste kolonnen) har alle grunnstoffa åtte elektron i det ytste skalet.
Grunnstoffa som høyrer til same gruppe i periodesystemet, har ofte ganske like eigenskapar.