Ionebinding og metallbinding
Elektronpar kan også dannes ved at elektroner går fra et atom til et annet. Natrium har ett uparet elektron i sitt ytterste skall. Klor har også ett uparet elektron i sitt ytterste skall.
Natrium gir fra seg ett elektron og får overskudd av positiv ladning. Det blir et positivt ion. Klor tar til seg ett elektron, og får overskudd av negativ ladning. Det blir et negativt ion.
Negative og positive ioner tiltrekkes av hverandre, og det oppstår bindinger mellom ionene. Som regel er det ionebindinger i stoffer som består av metall og ikke-metall.
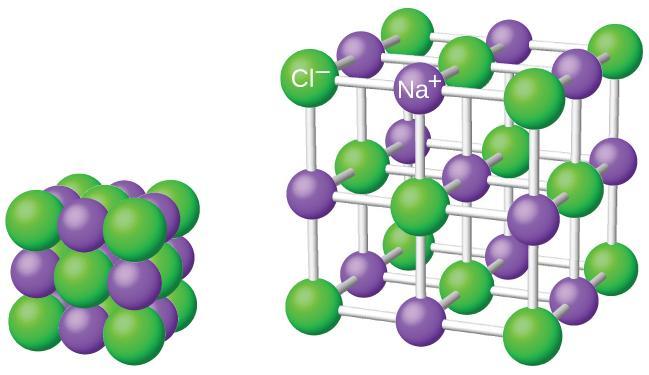
Det er aldri slik at vi har ionebinding mellom kun to enkeltioner. Ionene er bundet sammen i nettverk av positive og negative ioner. De utgjør det vi kaller et ionegitter.
Ioneforbindelser kalles gjerne for salter. Ordet salt i naturfag har en videre betydning enn i dagligtalen. Vi mener ikke bare det saltet som vi bruker i maten (NaCl), men alle forbindelser der atomene holdes sammen av ionebindinger.
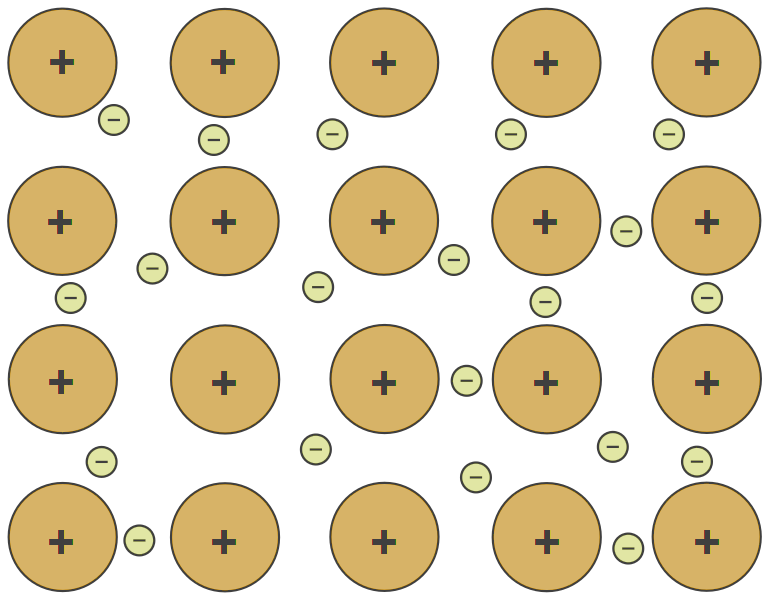
Metallbinding finnes bare i metallene. Her avgir atomene de ytterste elektronene til en felles elektronsky. De positive metallionene tiltrekkes av den negative elektronskyen og holder sammen.
De løst bundne elektronene gir metallene sine særegne egenskaper, for eksempel evnen til å lede strøm og varme.