Molekyler har ulike former
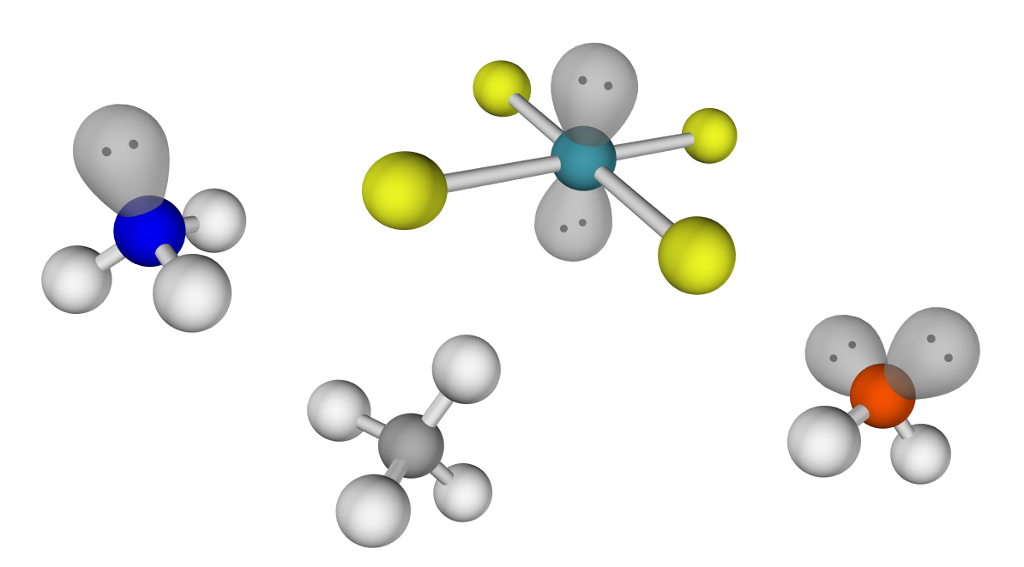
For å bestemme formen til et molekyl må vi vite hvilke atomtyper det er bygget opp av. Dette gir den kjemiske formelen oss informasjon om.
Eksempel:
Vann har kjemisk formel . Vannmolekylet består av to hydrogenatomer (H) og ett oksygenatom (O).
Deretter må vi finne ut hvor mange elektroner atomene har i det ytterste skallet sitt. Denne informasjonen kan vi finne i periodesystemet.
Eksempel:
Karbon (C) står i gruppe 14. Det siste sifferet i gruppenummeret er det samme som antall elektroner i det ytterste skallet.
Karbonatomer har altså 4 elektroner i det ytterste skallet sitt.
Elektronpar frastøter hverandre
Når vi skal fordele elektronene rundt atomene, kan vi legge merke til to ting:
- Elektroner opptrer i par, to og to.
- Elektronpar fordeler seg slik at de kommer så langt fra hverandre som mulig. I ytterskallet finnes elektronparene enten som bindinger mellom atomer eller som frie elektronpar.
For å få oversikt over hvordan ytterelektronene fordeler seg tegner vi elektronprikk-strukturen til molekylet:
- Finn ut hvor mange elektroner de ulike atomtypene i molekylet har i det ytterste skallet sitt.
- Fordel elektroner slik at atomene blir så stabile som mulig. For oksygen, nitrogen og karbon betyr dette 8 elektroner rundt hvert atom. Hydrogenatomet er stabilt med 2 elektroner rundt seg.
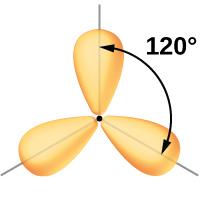
Vi har allerede vært inne på at elektronpar som befinner seg rundt et atom, vil fordele seg slikt at de kommer så langt unna hverandre som mulig. Dette kalles VSEPR-modellen.
Vi kan sammenligne dette med det som skjer når du knyter sammen to oppblåste ballonger: Ballongene vil "peke" i hver sin retning. Du kan forsøke å få ballongene til å ligge inntil hverandre ved å holde dem fast, men med en gang du slipper, så vil ballongene stille seg i motsatt retning av hverandre igjen.
Slik kan vi også tenke oss at elektronskyene til hvert av elektronparene forsøker å komme så langt fra hverandre som mulig.
Med utgangspunkt i elektronprikk-strukturen til et molekyl bruker vi VSEPR-modellen og forsøker å se for oss hva slags form molekylene har.
Slik kan du bestemme hvilken form et molekyl har:
- Tegn elektronprikkstrukturen til molekylet.
- Tell opp antall elektronpar rundt det sentrale atomet.
- Bruk antall elektronpar og VSEPR-modellen til å bestemme formen til molekylet.