Kjemiske bindinger
En kjemisk binding kan inntreffe på mange måter. Én mulighet er at ett eller flere elektroner i det ytterste elektronskallet trekkes ut i området mellom to atomer, slik at elektronene blir «delt» mellom de to atomene. Dette kalles en kovalent binding.
Atomer kan også holdes sammen på andre måter, for eksempel gjennom ionebindinger eller metallbindinger. Vi skal her se nærmere på alle disse tre bindingstypene.
Gassen metan består av grunnstoffene hydrogen (H) og karbon (C). Vi vet at hydrogen har ett elektron, og fra periodesystemet kan vi se at karbon har fire elektroner i det ytterste elektronskallet (karbon tilhører gruppe 14).
Hydrogen vil alltid forsøke å skaffe seg ett ekstra elektron slik at det får to elektroner i elektronskallet sitt. Da er dette skallet fullt. Alle andre atomer vil forsøke å oppnå åtte elektroner i det ytterste skallet. Siden karbon har fire elektroner fra før, vil det altså gjerne ha fire ekstra.
Dersom fire hydrogenatomer deler sine elektroner med ett karbonatom, vil hele regnestykket gå opp! Hvert av hydrogenatomene får to elektroner i sitt ytterste skall, og karbonatomet får åtte elektroner i sitt ytterste skall.
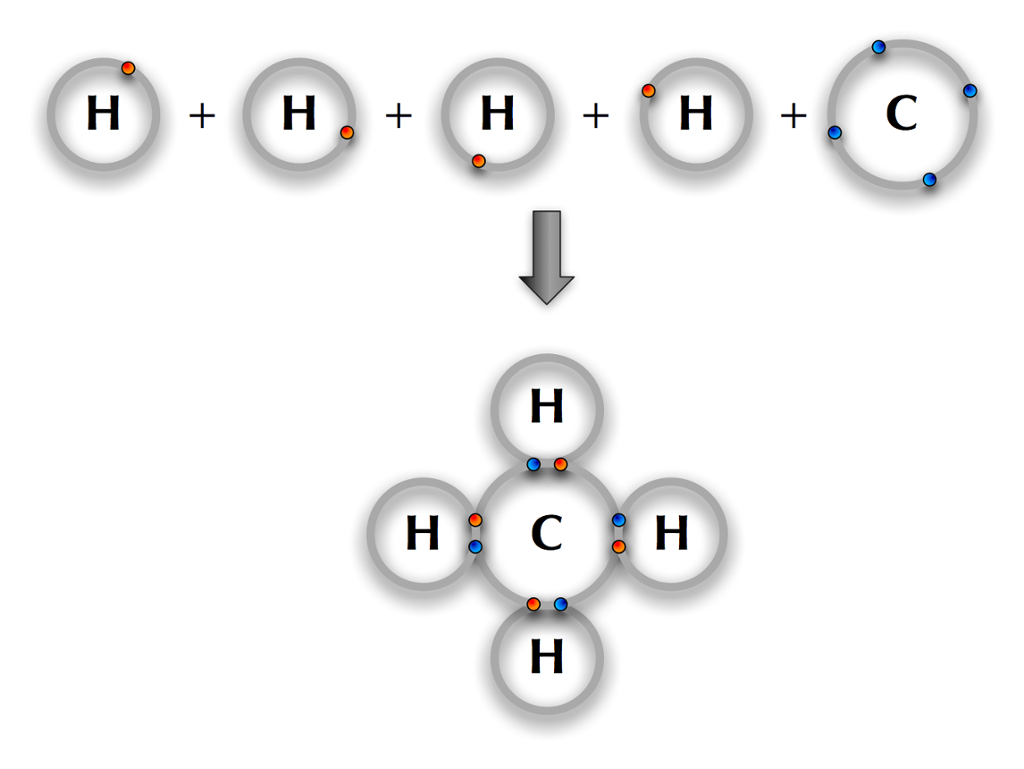
Atomer vil forsøke å skaffe seg åtte elektroner i det ytterste skallet ved å danne bindinger med andre atomer. Dette kalles åtteregelen.
Åtteregelen er veldig viktig og vil hjelpe deg å forstå hvordan grunnstoffer kan danne molekyler. I kjemien er det elektronene i det ytterste elektronskallet til et atom som er viktig. Kjernepartiklene (protoner og nøytroner) trenger vi ikke å bry oss om her.
Elektronene i det ytterste skallet til et atom kaller vi valenselektroner. Disse elektronene har stor betydning for hvilke kjemiske forbindelser atomet kan inngå i.
La oss se nærmere på hvordan dette foregår i vann. Oksygen har seks valenselektroner og mangler altså to elektroner for å oppfylle åtteregelen. Oksygenet kan oppfylle regelen ved å dele elektroner med to hydrogenatomer.
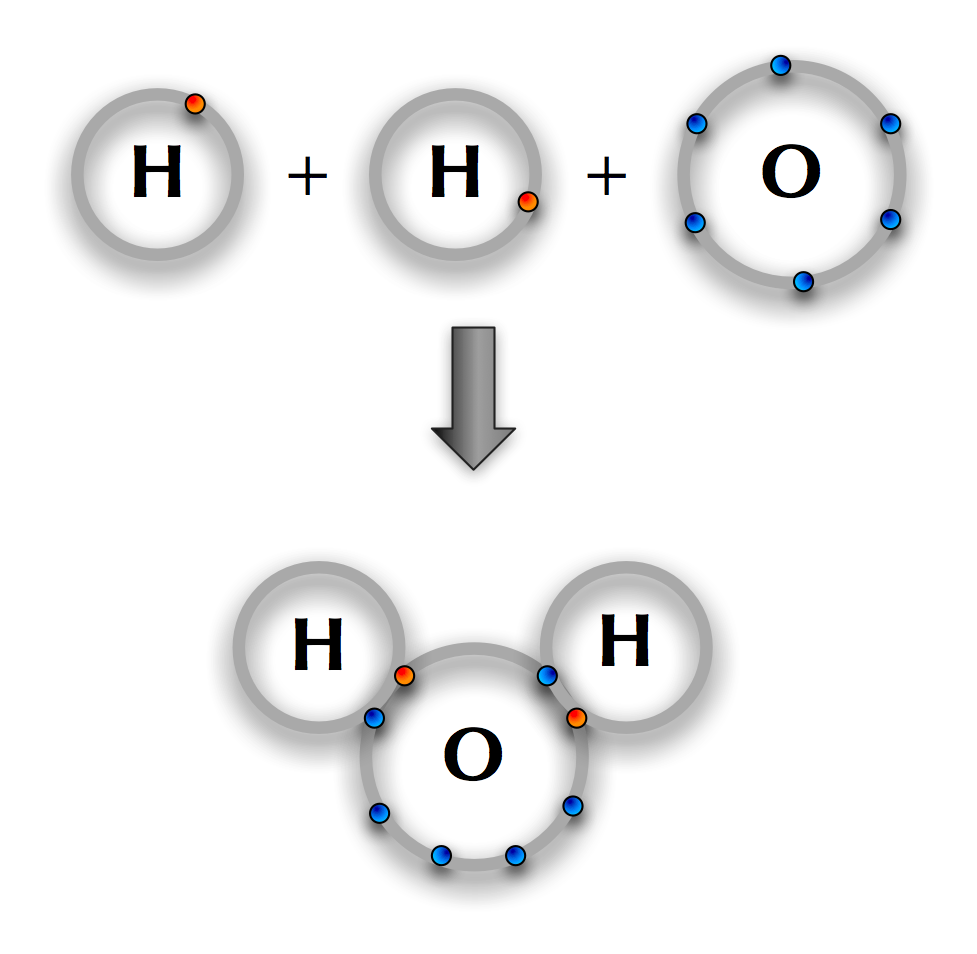
Bindingen mellom hydrogen og vann er litt spesiell. Det er nemlig slik at elektronene som deles, havner litt nærmere oksygenatomet enn hydrogenatomet. Siden elektroner har negativ ladning, vil vannmolekylet bli litt negativt ladet ved oksygenatomet. Ved hydrogenatomene vil det være svakt positivt ladet. Slike bindinger sier vi er polare kovalente.
I figuren over ser du at hydrogenatomene og oksygenatomet ikke står oppstilt langs en rett linje, men at de har havnet i en vinkel hverandre. Årsaken til dette er den lille «skjevfordelingen» av elektroner.
Noen grunnstoffer kan gi fra seg ett eller flere elektroner fullstendig. Da blir det færre elektroner enn protoner, og atomet blir positivt ladet. Andre grunnstoffer kan ta til seg ett eller flere elektroner. Da blir det flere elektroner enn protoner, og atomet blir negativt ladet.
Et ion er et ladet atom. Ladningen kommer av at atom gir fra seg eller tar til seg elektroner.
Atomer med ulik elektrisk ladning (positiv og negativ) vil tiltrekke hverandre. På denne måten får vi det vi kaller ionebindinger. Et eksempel på en ionebinding er natriumklorid (NaCl).
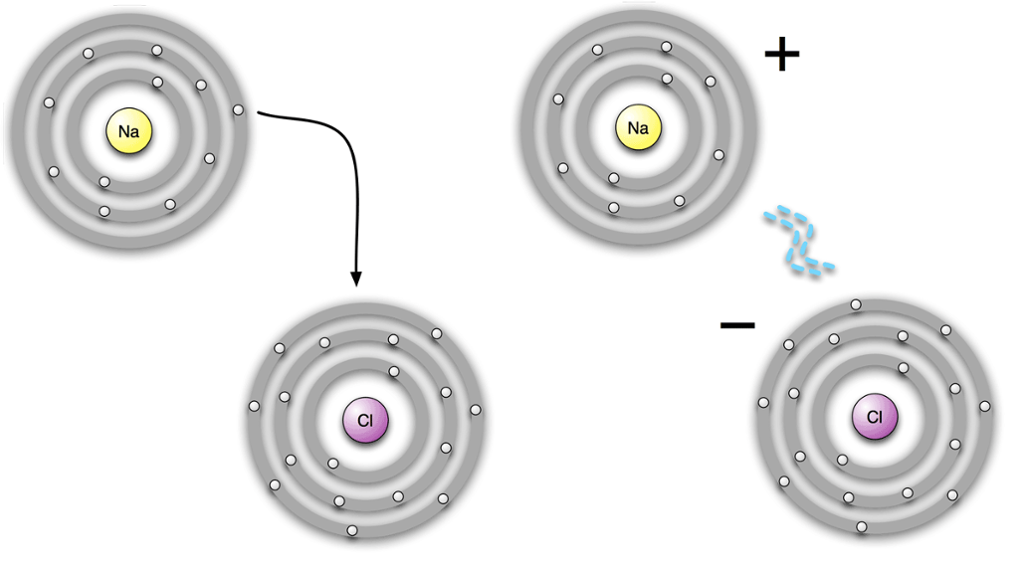
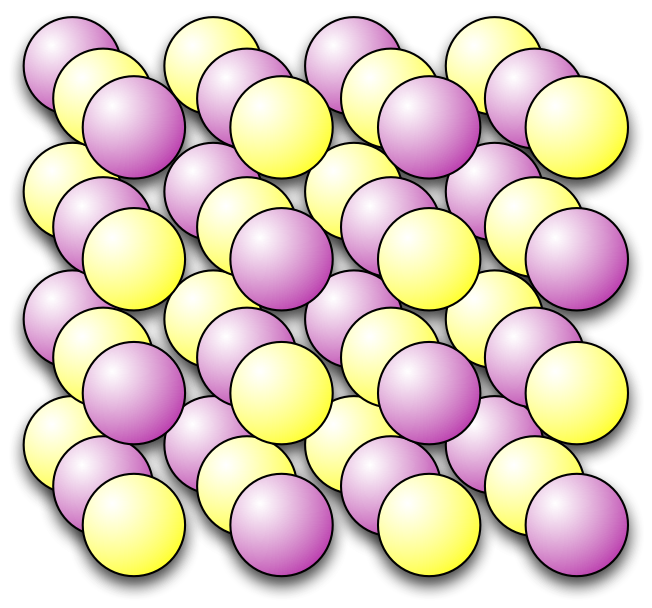
Forskjellen i ladning gjør at atomene dras mot hverandre og blir organisert parvis i negativ og positiv rekkefølge i en kubestruktur. Dette kaller vi et ionisk krystall.
Ionebindinger skjer vanligvis mellom et grunnstoff som er et metall, og et grunnstoff som ikke er et metall. I vårt eksempel er natrium et metall, og klor er ikke et metall. Det er alltid valenselektronene til metallet som avgis, og som blir tatt opp av ikke-metallet.
De aller fleste grunnstoffene er metaller. Når de er i ren form, holdes atomene sammen med det som kalles metallbinding. På samme måte som for ionebindinger avgir atomene valenselektronene. Men siden metallet nå er i ren form, finnes det ikke noen andre atomer som kan ta opp disse elektronene. Dermed blir det liggende en «sky» av elektroner mellom metallatomene. Dette gjør at metaller er gode ledere av elektrisk strøm.

Valenselektronene til hvert enkelt atom blir nå «felles» for alle de andre atomene i metallbindingen.
I metallbindinger blir «frie» elektroner delt mellom flere metallatomer.
Metallbindinger er sterke, og det skal mye til for å bryte dem opp. Grunnstoffet wolfram (W) har et kokepunkt på hele 5555 °C!