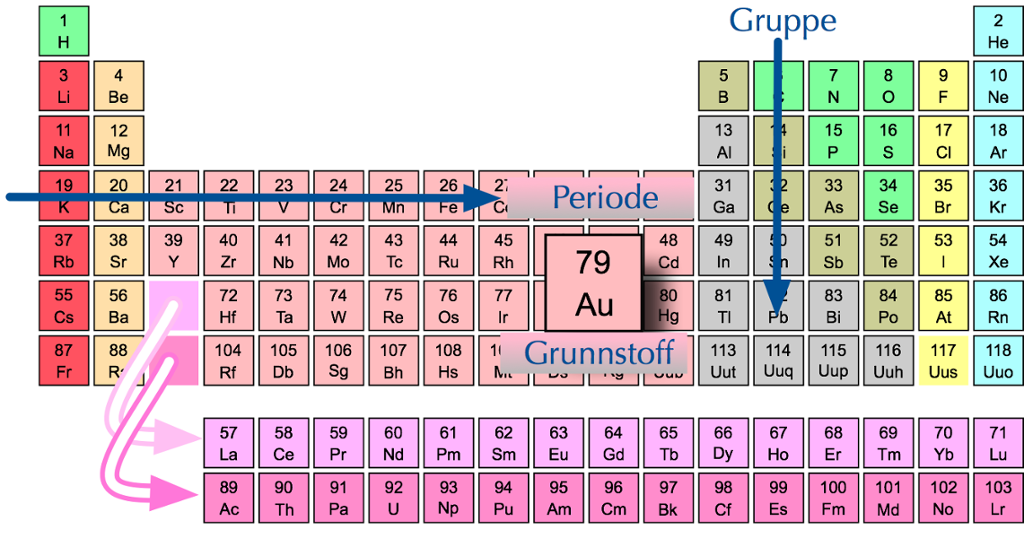
Periodesystemet
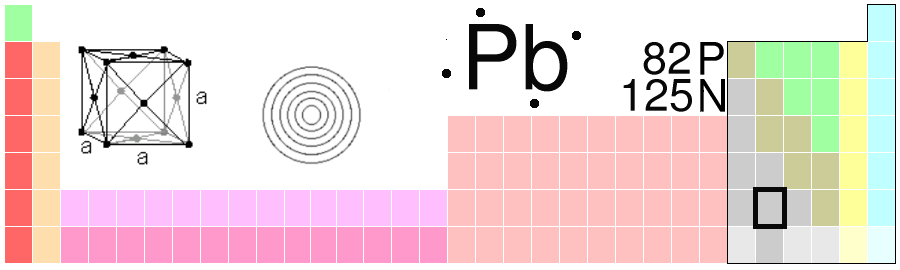
For eksempel har hydrogen atomnummer 1, helium har atomnummer 2, og så videre. I tillegg har alle grunnstoffer et navn og et kjemisk symbol. Symbolet består av én eller to bokstaver og er det samme på alle verdens språk. Slik er det ikke med navnene til grunnstoffene. For eksempel heter det “bly” på norsk, mens det heter “lead” på engelsk. Det kjemiske symbolet derimot er det samme på begge språk: Pb. Vi kan si at vi har et eget “kjemispråk”.
Alle grunnstoffer har et kjemisk symbol som består av én eller to bokstaver. I motsetning til stoffets navn er symbolet felles på alle språk.
Alle grunnstoffene kan ordnes på en oversiktlig måte i en tabell som vi kaller periodesystemet. Vi begynner øverst til venstre og stiller grunnstoffene opp etter økende atomnummer.
I periodesystemet er grunnstoffene ordnet etter stigende atomnummer.
Radene i periodesystemet kalles perioder. I den første perioden finner vi hydrogen (H) og helium (He). Disse grunnstoffene har bare ett elektronskall.
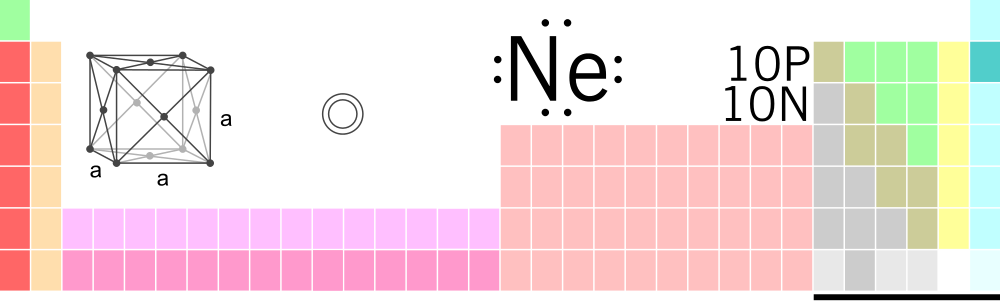
I den andre perioden finner vi alle grunnstoffene med to elektronskall. Disse grunnstoffene har plass til 10 elektroner – 2 i det innerste skallet og 8 i det ytterste skallet. Grunnstoffet neon (Ne) har ti protoner og ti elektroner. To av elektronene er i det innerste skallet, og da må det være åtte elektroner i det neste skallet.
Grunnstoffet natrium (Na) har elleve protoner og elleve elektroner. Det har to elektroner i det innerste skallet og åtte elektroner i det neste skallet. Siden det ikke er plass til flere i det andre skallet, får det siste elektronet plass i et tredje skall. I den tredje perioden finner vi alle grunnstoffer med tre elektronskall. Slik fortsetter det nedover i periodene.
I periodesystemet deles grunnstoffene inn i perioder etter antall elektronskall.

I 1869 laget den russiske kjemiprofessoren Dmitrij Ivanovitsj Mendelejev det første utkastet til periodesystemet. Han organiserte grunnstoffene etter atomvekt og kjemiske egenskaper.
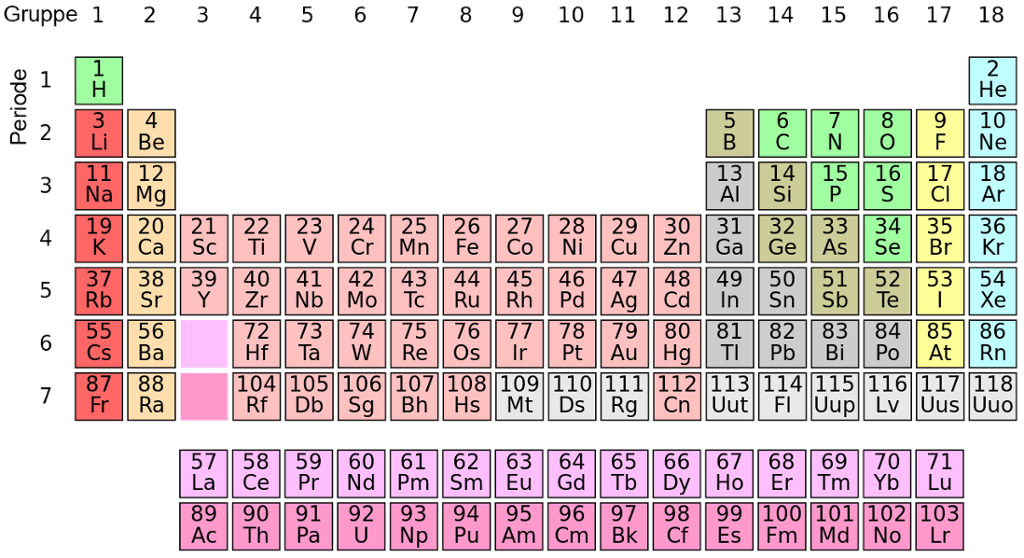
Grunnstoffene ble opprinnelig ordnet i kolonner avhengig av stoffenes kjemiske egenskaper. Det vil si at de grunnstoffene som er i samme kolonne, ligner litt på hverandre i måten de reagerer med andre stoffer på. Dette henger nøye sammen med hvor mange elektroner et grunnstoff har i det ytterste skallet.
Grunnstoffene hydrogen (H), litium (Li) og natrium (Na) har ett elektron i det ytterste elektronskallet. Derfor plasserer vi disse i den første kolonnen. Denne kolonnen kaller vi gruppe 1.
Den neste kolonnen inneholder grunnstoffer med to elektroner i det ytterste skallet, og denne kaller vi gruppe 2. Grunnstoffene i gruppe 3–12 har ett eller to elektroner i det ytterste skallet. I gruppe 13 har alle grunnstoffene tre elektroner i det ytterste skallet, og i gruppe 14 har alle grunnstoffene fire elektroner i det ytterste skallet.
Slik fortsetter det bortover i gruppene. I gruppe 18 (den siste kolonnen) har alle grunnstoffene åtte elektroner i det ytterste skallet.
Grunnstoffer som tilhører samme gruppe i periodesystemet, har ofte ganske like egenskaper.