Ionebinding og metallbinding
Elektronpar kan også dannast ved at elektron går frå eit atom til eit anna. Natrium har eitt upara elektron i sitt ytste skal. Klor har også eitt upara elektron i sitt ytste skal.
Natrium gir frå seg eitt elektron og får overskot av positiv ladning. Det blir eit positivt ion. Klor tar til seg eitt elektron, og får overskot av negativ ladning. Det blir eit negativt ion.
Negative og positive ion blir tiltrekte av kvarandre, og det oppstår bindingar mellom iona. Som regel er det ionebindingar i stoff som består av metall og ikkje-metall.
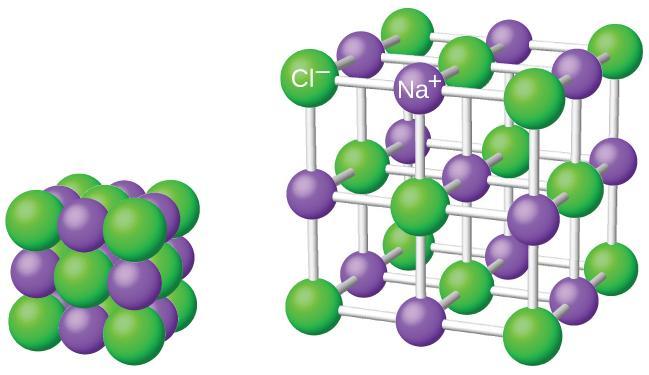
Det er aldri slik at vi har ionebinding mellom berre to enkeltion. Iona er bundne saman i nettverk av positive og negative ion. Dei utgjer det vi kallar eit ionegitter.
Ioneforbindelsar blir gjerne kalla for salt. Ordet salt i naturfag har ei vidare betyding enn i daglegtalen. Vi meiner ikkje berre det saltet som vi bruker i maten (NaCl), men alle forbindelsar der atoma blir haldne saman av ionebindingar.
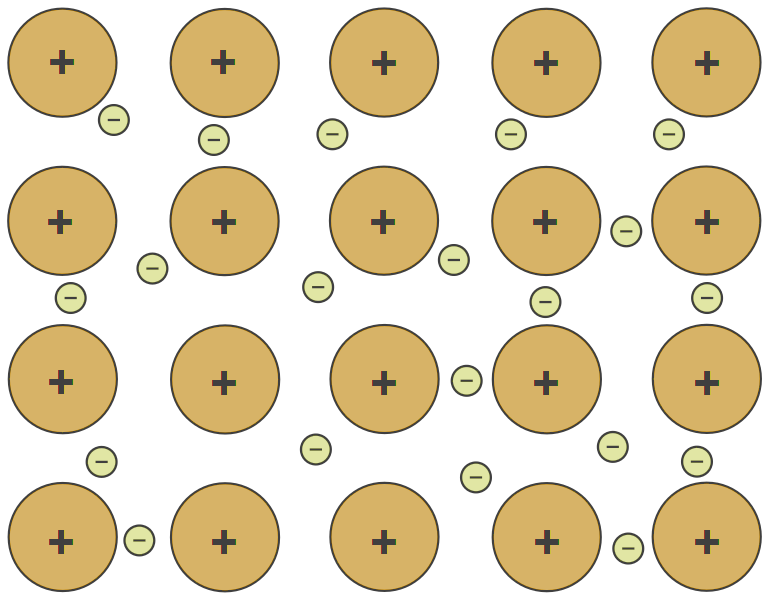
Metallbinding finst berre i metalla. Her gir atoma frå seg dei ytste elektrona til ei felles elektronsky. Dei positive metalliona blir tiltrekte av den negative elektronskya og held saman.
Dei laust bundne elektrona gir metalla sine særeigne eigenskapar, til dømes evna til å leie straum og varme.