Åtteregelen
Åtteregelen (eller oktettregelen) er ein regel som seier at atom er stabile med åtte elektron i det ytste skalet. Edelgassane (bortsett frå helium) har åtte elektron i det ytste skalet i utgangspunktet. Edelgassane er stabile, dei reagerer i liten grad med andre atomtypar. Når eit atom har åtte elektron i det ytste skalet, seier vi at det har edelgasstruktur.
Atom som ikkje allereie har åtte elektron ytst, vil prøve å oppnå dette ved å
dele elektron med andre atom
gi frå seg eller ta til seg elektron
Åtteregelen seier at atom er stabile med åtte elektron i det ytste skalet.
Dele elektron
To ikkje-metall kan oppnå åtte elektron i det ytste skalet ved å dele på elektronpar mellom seg. Det delte elektronparet er eigd av begge atoma slik at begge "føler" at dei har åtte elektron i det ytste skalet.
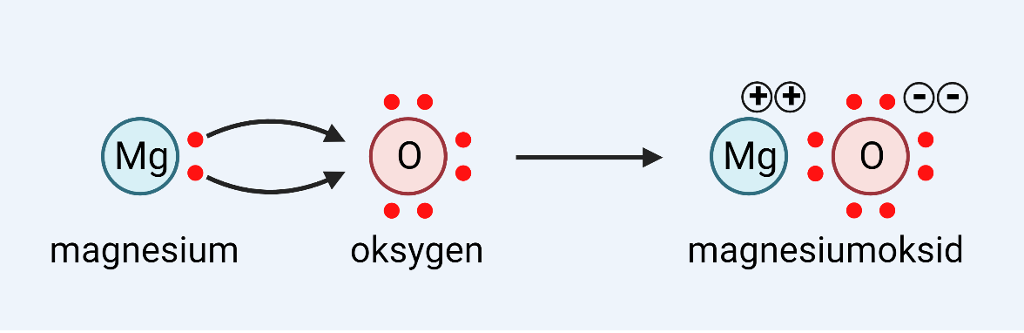
Atom kan oppnå åtte elektron i det ytste skalet ved å få eller gi frå seg elektron eller ved å dele elektron. Dette skjer når eit metall gir frå seg elektron til eit ikkje-metall.
Når atom oppfyller åtteregelen ved å dele elektron, er det ikkje alltid dei deler heilt likt på elektrona.
Nokre atomtypar trekker elektrona meir mot seg enn andre. Desse atomtypane har høgare elektronegativitet enn motparten sin.
Elektronegativitet er eit mål på kor stor evne eit atom har til å tiltrekke seg elektron i ei binding.
Periodesystemet avslører elektronegativiteten
Periodesystemet under gir oversikt over kor elektronegative dei ulike grunnstoffa er. Fluor er det grunnstoffet som har høgast elektronegativitet, og det har fått verdien fire.
Sjølv om du ikkje har gitt opp elektronegativitetsverdiane, kan du bruke plasseringa til grunnstoffa i periodesystemet til å vurdere stoff opp mot kvarandre.
Studer figuren og sjå om du finn kva trend verdiane følger.