Molekyl har ulike former
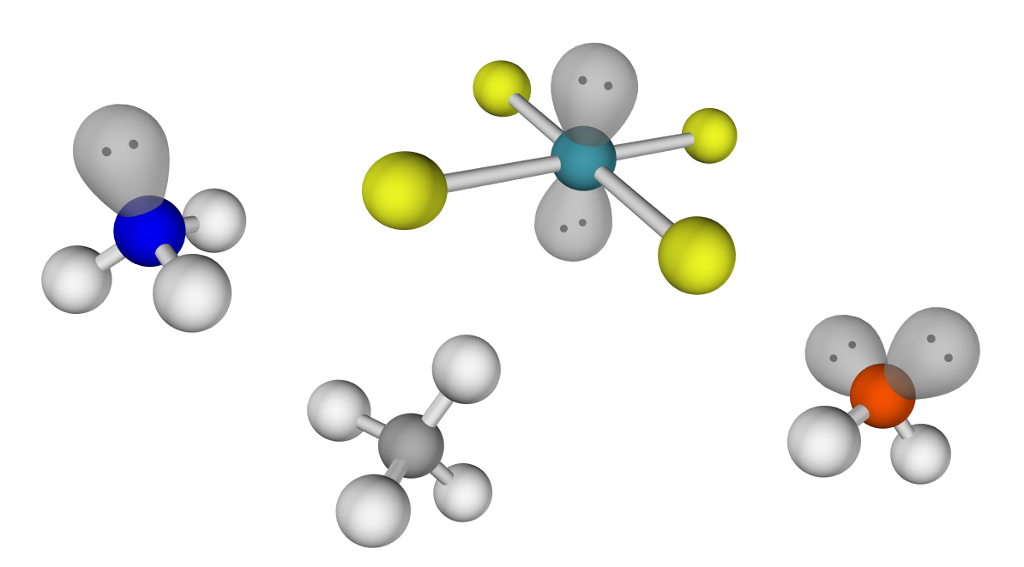
For å bestemme forma til eit molekyl må vi vite kva atomtypar det er bygd opp av. Dette gir den kjemiske formelen oss informasjon om.
Døme:
Vatn har kjemisk formel . Vassmolekylet består av to hydrogenatom (H) og eitt oksygenatom (O).
Deretter må vi finne ut kor mange elektron atoma har i det ytste skalet sitt. Denne informasjonen kan vi finne i periodesystemet.
Døme:
Karbon (C) står i gruppe 14. Det siste sifferet i gruppenummeret er det same som talet på elektron i det ytste skalet.
Karbonatom har altså 4 elektron i det ytste skalet sitt.
Elektronpar fråstøyter kvarandre
Når vi skal fordele elektrona rundt atoma, kan vi legge merke til to ting:
- Elektron opptrer i par, to og to.
- Elektronpar fordeler seg slik at dei kjem så langt frå kvarandre som mogleg. I ytterskallet finst elektronpara anten som bindingar mellom atom eller som frie elektronpar.
For å få oversikt over korleis ytterelektrona fordeler seg, teiknar vi elektronprikk-strukturen til molekylet:
- Finn ut kor mange elektron dei ulike atomtypane i molekylet har i det ytste skalet sitt.
- Fordel elektron slik at atoma blir så stabile som mogleg. For oksygen, nitrogen og karbon betyr dette 8 elektron rundt kvart atom. Hydrogenatomet er stabilt med 2 elektron rundt seg.
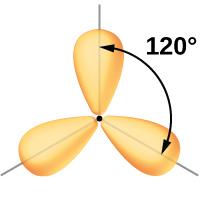
Vi har allereie vore inne på at elektronpar som er rundt eit atom, vil fordele seg slik at dei kjem så langt unna kvarandre som mogleg. Dette blir kalla VSEPR-modellen.
Vi kan samanlikne dette med det som skjer når du knyter saman to oppblåste ballongar: Ballongane vil "peike" i kvar si retning. Du kan prøve å få ballongane til å liggje inntil kvarandre ved å halde dei fast, men med ein gong du slepp, så vil ballongane stille seg i motsett retning av kvarandre igjen.
Slik kan vi òg tenke oss at elektronskyene til kvart av elektronpara prøver å komme så langt frå kvarandre som mogleg.
Med utgangspunkt i elektronprikk-strukturen til eit molekyl bruker vi VSEPR-modellen og prøver å sjå for oss kva slags form molekyla har.
Slik kan du bestemme kva form eit molekyl har:
- Teikn elektronprikkstrukturen til molekylet.
- Tel opp elektronpar rundt det sentrale atomet.
- Bruk talet på elektronpar og VSEPR-modellen til å bestemme forma til molekylet.