Laboratoriøving med brine
Den viktigaste eigenskapen til ei kompletteringvæske er densiteten, altså kor mykje ho veg, målt i kg per liter. For å oppnå densiteten vi vil ha, tilset vi salt til ferskvatn.
Type brine | Navn | Maks densitet utblandet | Tilsvarende vekt-% |
|---|---|---|---|
| KCl | kaliumklorid | 1,16 | 24 |
| NaCl | natriumklorid | 1,20 | 26 |
| NaBr | natriumbromid | 1,52 | 46 |
| CaCl2 | kalsiumklorid | 1,39 | 40 |
| CaBr2 | kalsiumbromid | 1,80 | 58 |
| NaCOOH | natriumformiat | 1,33 | 47 |
| KCOOH | kaliumformiat | 1,57 | 77 |
| CsCOOH | cesiumformiat | 2,30 | 83 |
Tabellen viser kor høg densitet vi kan oppnå med kvar enkelt salttype når vatnet er metta med saltet.
Det er òg mogleg å blande nokre av salta. På den måten oppnår vi løysningar med andre maksimale densitetar.
Type brine | sg utblanda |
|---|---|
NaCl/NaBr | 1,21–1,49 kg/l |
NaHCO2/KHCO2 | 1,34–1,57 kg/l |
CaCl2/CaBr2 | 1,40–1,81 kg/l |
CaBr2/ZnBr2 | 2,30 kg/l |
CaCl2/CaBr2/ZnBr2 | 1,84–2,29 kg/l |
Det er ikkje naudsynt å rekne ut kor mykje salt vi må tilsetje vatnet for å oppnå ein bestemd densitet. Vi bruker heller brinetabellar, som i Drilling Data Handbook (DDH). Desse er baserte på empiriske data, det vil seie forsøk og erfaringar.
I kapittel H i DDH er det tabellar som viser ulike salt og eigenskapane deira. Det er oppgitt kor mykje salt og vatn som må blandast for å oppnå bestemde densitetar.
Dersom vi skal lage ei kompletteringvæske med ein densitet på 1,16 kg/l, kan vi bruke ein brinetabell for å gjere nokre val. Vi ser då at kaliumklorid (potassium chloride) er det beste alternativet. Maksimum densitet med dette saltet er 1,16 kg/l, og det er eit relativt billig salt.
I tabellen i DDH ser vi at om vi skal ende opp med 1 m3 løysning med densitet på 1,16 kg/l, må vi tilsetje 279,6 kg KCl til 0,883 m3 ferskvatn.
For å sjekke densiteten til væska treng vi eit hydrometer, ein behaldar og eit termometer. Er densiteten heilt ukjend, kan vi bruke mudvekta (som vi bruker til å måle densiteten til borevæske) for å få eit cirkabilete av densiteten.
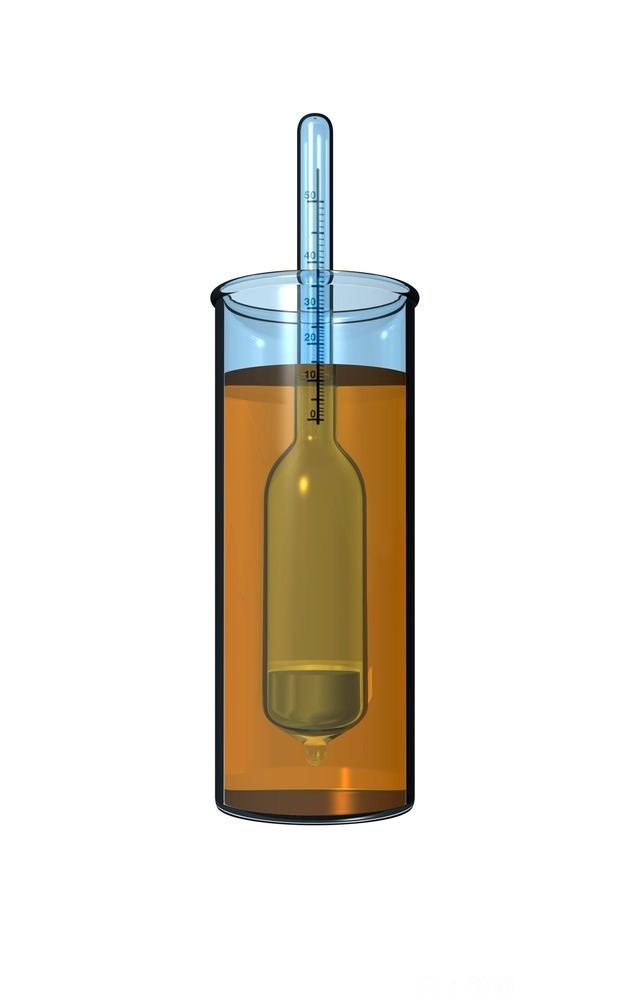
Eit hydrometer er eit instrument som måler den relative densiteten til væsker, det vil seie forholdet mellom densiteten til væska og densiteten til reint vatn. Hydrometera er laga med avgrensa skalaer til ulike samanhengar.
Eit hydrometer er vanlegvis laga av glas og består av ein stamme og ein kolbe fylt med kvikksølv eller små blykuler. Væska som skal testast, blir fylt i ein behaldar (sylinder) som er djup nok. Vi senkar hydrometeret sakte ned i væska heilt til det (hydrometeret) flyt fritt.
Desto lågare densitet det er på væska, jo lågare ned søkk hydrometeret, basert på prinsippet for oppdrift.
Den spesifikke vekta les vi av på ein skala på stammen av hydrometeret, der overflata til væska ligg. Det er viktig at væskene er ved romtemperatur når vi skal lese av densiteten.
Vi har ein brine med ukjend densitet. Væska har ein temperatur på 4 °C. Vi ønskjer å finne nøyaktig densitet. Først må væska varmast opp til romtemperatur. Vi måler densiteten i ei mudvekt og ser at han er om lag 1,40 sg. Vi må velje eit hydrometer med rett skala.
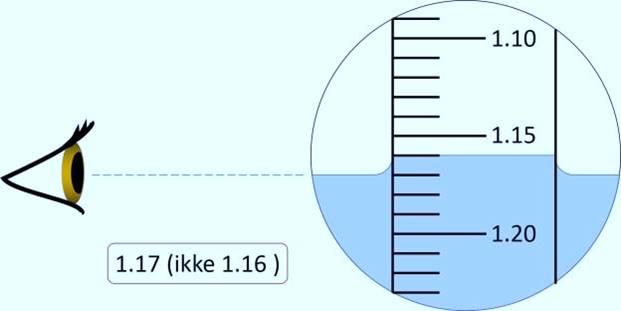
Så fyller vi væska sakte i ein litt stor sylinder. Vi må unngå at det dannar seg bobler i væska. Vi senkar hydrometeret ned i sylinderen heilt til det flyt sjølv. Vi les av den nøyaktige densiteten på skalaen på stammen på hydrometeret, og vi ser at han er 1,39 sg. Punktet for avlesing er der væskeoverflata er, ikkje der væska går opp nær glasveggen.
Lag 1 liter saltløysning.
Bland vatn med eit salt frå laboratoriet (skulane har ulike samlingar med salt, vel frå lageret). Bruk ein blandingstabell for å finne ut kor mykje salt og vatn du skal blande. Hugs temperaturen.
Sjekk densiteten ved hjelp av ei mudvekt og eit hydrometer.
Tilset 100 ml reint vatn. Sjekk densiteten på ny.
Bruk rapportgeneratoren over til å lage ein refleksjon over øvinga og kva du lærte om brine.
Relatert innhald
Kompletteringsvæsken erstatter boreslam i brønnen etter at borefasen er avsluttet, for å opprettholde den hydrostatiske trykkbalansen i brønnen.
Kompletteringsvæsker er saltløsninger som lages av rent vann blandet med salter som f.eks. kaliumklorid, natriumklorid, kalsiumklorid eller kalsiumbromid.