Saltene til kompletteringsvæsken

- KCl (kaliumklorid)
- NaCl (natriumklorid)
- CaCl2 (kalsiumklorid)
- NaBr (natriumbromid)
- CaBr2 (kalsiumbromid)
- NaCOOH (natriumformat)
- KCOOH (kaliumformat)
- CsCOOH (cesiumformat)
Vi blander salt i vann for å oppnå en høyere egenvekt. Det trenger vi for å får nok hydrostatisk trykk til å ha brønnkontroll mot trykket fra reservoaret. De enkleste kompletteringsvæskene er NaCl- og KCl-brine. Disse passer best når vektbehovet i væsken er lavt. Andre løsninger mikser flere typer salt sammen for å oppnå noe høyere vekt uten å øke prisen for mye, som f.eks. miksen NaCl/NaBr.
Noen ganger brukes formater som f.eks. natriumformat, kaliumformat og cesiumformat.
Formater dannes ved å nøytralisere maursyre med basiske salter. Formater brukes spesielt i HPHT-brønner fordi de kan blandes til ekstra høy densitet. De er miljøvennlige, stabile og reduserer faren for skade på formasjonen.
Bromider brukes vanligvis i formasjoner som har høyt trykk (og høy temperatur), fordi de kan oppnå høyere densitet i saltløsningen, men ettersom de er dyre i innkjøp brukes de ikke når det ikke er nødvendig.
Valget av salt-type bestemmes av formasjonstrykk og -temperatur. Det er også viktig at væskene passer til formasjonens mineraler, slik at det ikke dannes bindinger som kan endre formasjonens egenskaper eller danne uløselige krystaller som kan plugge formasjonen.
Temperaturen i brønnen er avgjørende for hvor mye salt som kan løses opp i væsken. Temperaturen stiger lineært med dypet i brønnen, og reservoar med høyt trykk kan ha høy temperatur.
Vann kan løse opp ca. 28 % kaliumklorid salt ved 0° Celsius.
Vann kan løse opp ca. 56 % kaliumklorid salt ved 100° Celsius.
Det er kaldest ved overflaten der væskene blandes, derfor må vekten av den ferdigblandede væsken beregnes ut fra reservoartemperaturen. Når væsken sirkuleres gjennom brønnen blir den oppvarmet av reservoartemperaturen. Når væsken varmes opp, øker væskevolumet, og tettheten i saltkonsentrasjonen minker. Dersom det tilsettes for lite salt, kan væsken bli for lett når den har blitt oppvarmet av formasjonstemperaturen. Det kan medføre underbalanse i brønnen.
Det er også viktig å passe på krystalliseringsgrensen for saltet. Krystallisering er prosessen der et stoff danner en fast gitterstruktur mellom flere molekyler. Dette skjer blant annet når et stoff blir utfelt fra en saltløsning, ved fall i væsketemperatur.
Når væsken kjøles ned igjen ved stans i sirkulasjonen, kan det oppløste saltet danne krystaller i væsken. Krystallene faller til bunns i væsken i tanken og blir derfor ikke med i sirkulasjonen når denne starter opp igjen. Vekten av saltet og løseligheten avgjør hvor tung væsken kan bli. Egenvekten på de ulike saltløsningene vises i tabellen.
Type brine | Navn | Max SG utblandet | Tilsvarende vekt-% |
|---|---|---|---|
KCl | kaliumklorid | 1,16 kg/l | 24 |
NaCl | natriumklorid | 1,20 kg/l | 26 |
NaBr | natriumbromid | 1,52 kg/l | 46 |
CaCl2 | kalsiumklorid | 1,39 kg/l | 40 |
CaBr2 | kalsiumbromid | 1,80 kg/l | 58 |
NaCOOH | natriumformat | 1,33 kg/l | 47 |
KCOOH | kaliumformat | 1,57 kg/l | 77 |
CsCOOH | cesiumformat | 2,30 kg/l | 83 |
Forklaring på vekt-% (vektprosent):
1 liter KCl brine blandet til 1,16 sg veier 1,16 kg.
Den inneholder 24 vekt-% KCl som tilsvarer 1,16 · 0,24 = 0,278 kg KCl
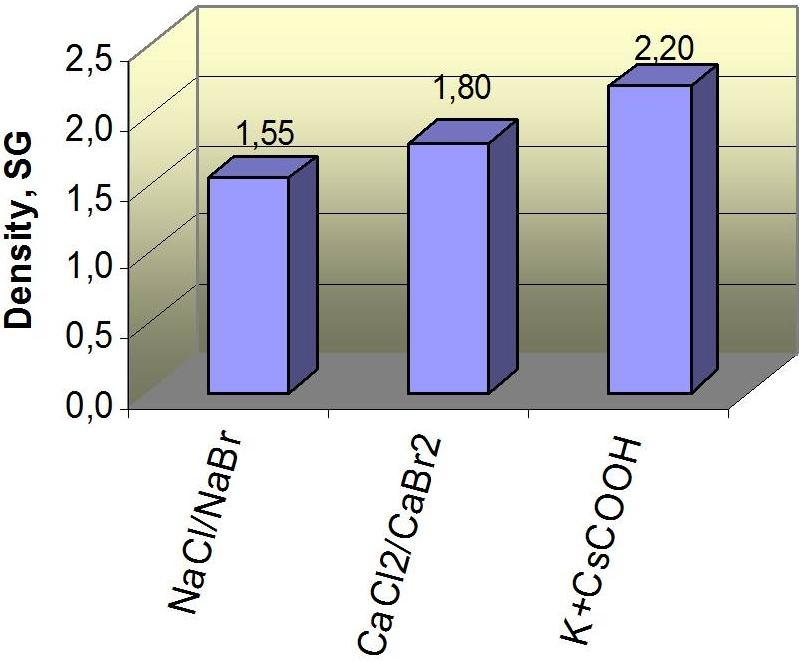
Ulike salttyper kan også blandes for å oppnå bedre formasjonstilpasning eller bedre densitetstilpasning, uten at kostnadene blir uoverkommelige.
For eksempel kan kalsiumklorid og kalsiumbromid blandes (CaCl2/CaBr2) slik at maksimum densitet økes fra 1,39 sg for ren kalsiumklorid til et nivå opp mot 1,80 sg som er ren kalsiumbromid.
La oss se litt nærmere på en situasjon med valg av kompletteringsvæske ut fra to kriterier: den skal passe til reservoartypen og den skal bidra til brønnkontroll.
Relatert innhald
Korleis aukar og reduserer ein densiteten til ei kompletteringvæske? Her er litt teori og ei øving.
Kompletteringsvæsken erstatter boreslam i brønnen etter at borefasen er avsluttet, for å opprettholde den hydrostatiske trykkbalansen i brønnen.