Syrer og baser
I siste del av forrige hundreår begynte en å søke etter forklaringer på hva syrer og baser egentlig var. Hva er likt hos alle syrer? Og hva er likt hos alle baser? Hva er det som avgjør om et stoff skal bli en syre eller en base?
Den vanligste definisjonen av syre og base er:
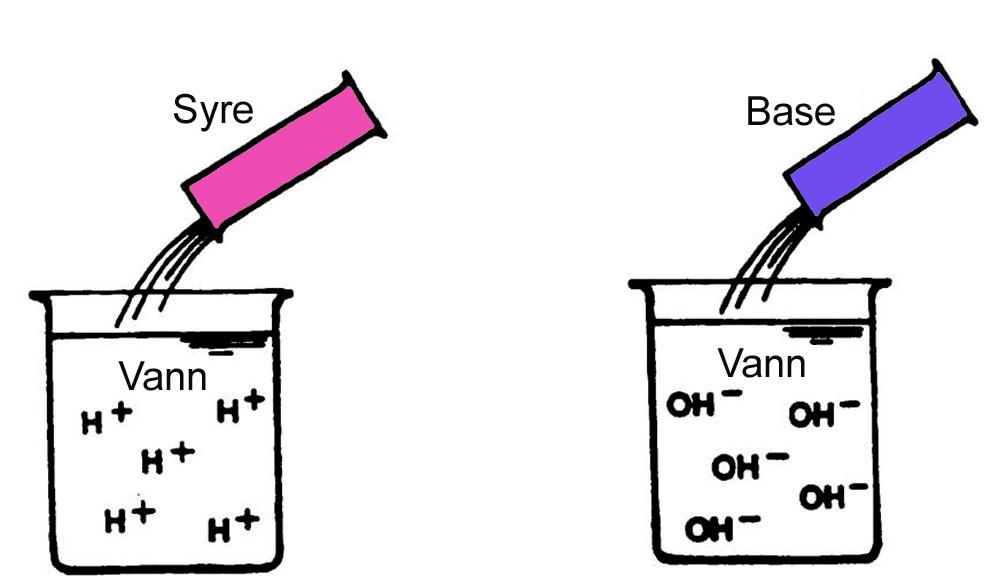
En syre er et stoff som kan avgi protoner (H+) i vann, altså en protongiver.
En base er et stoff som kan oppta protoner (H+) i vann, altså en protonmottaker, eller et stoff som kan avgi OH–-ioner i vann.
Mange av syrene har vært kjent så lenge at bestemte navn fra dagligtalen blir brukt. Men vi skriver alltid syreformlene på samme måte, med hydrogen først.
De best kjente av syrene er:
- Saltsyre: HCl (enverdig syre eller enprotisk syre)
- Salpetersyre: HNO3 (enverdig syre eller enprotisk syre)
Det som er forskjellig for alle syrer, og som derfor på en eller annen måte gir syren navn, er syreresten. Syreresten er den delen av syra som er igjen når hydrogenet (ene) er tatt bort.
For eksempel er syreresten til saltsyre kloridionet (Cl-). Syreresten til svovelsyre er sulfationet (SO42-) og så videre. At syrerestene er negative ioner, kommer av at når hydrogenatomet spaltes av fra syra, har det formen H+, elektronet blir igjen på syreresten.
Hydroksider er stoffer som har OH–-ioner i formelen. Når slike hydroksider kommer i vann, spaltes OH−-ionene av og danner baser. Mange av de viktigste basene vi skal lære om, er nettopp hydroksider løst i vann. Her er noen :
- Natronlut = vannløsning av natriumhydroksid = NaOH
- Kalilut = vannløsning av kaliumhydroksid = KOH
- Kalkvann = vannløsning av kalsiumhydroksid = Ca(OH)2
Ammoniakk NH3 er også en base, for når NH3 løses i vann, blir det dannet OH–-ioner i vannet akkurat som for de andre basene.
NH3 + H2O → NH4+ + OH-
Syrer og baser er etsende væsker. Søler vi på klærne, blir det hull i stoffet. På huden kan det bli stygge brannsår. Skyll straks med store mengder vann. Ved sprut i øynene − skyll med vann, og kontakt lege hurtigst mulig!