Fysiske egenskaper bestemmes av formen på molekylene

Kreftene som virker mellom molekyler, er mye svakere enn kreftene som virker mellom atomer, for eksempel kovalente bindinger.
Det er vanlig å dele kreftene mellom molekyler inn i tre typer:
- krefter mellom upolare molekyler
- krefter mellom polare molekyler
- hydrogenbindinger
Elektroner beveger seg hele tiden. Et elektronpar som deles likt mellom to hydrogenatomer i H–H, kan derfor i et lite øyeblikk være nærmere det ene H-atomet enn det andre.
Da oppstår det en ladningsforskjell, og molekylet får en negativ pol og en positiv pol. I neste øyeblikk blir elektronparet trukket motsatt vei, og ladningen i molekylet blir motsatt av det den var. Slik fortsetter det, og hvilken pol som er negativ og positiv, skifter hele tiden. Slike molekyler kaller vi midlertidige dipoler.
Denne midlertidige ladningsforskjellen gjør at upolare molekyler også kan holde sammen til en viss grad. De tiltrekkende kreftene som oppstår, er derimot svake, og det skal lite til for å «rive» molekylene fra hverandre.
Jo større masse, jo sterkere krefter
Krefter mellom midlertidige dipoler er svake, og molekylene må være veldig nær hverandre for å bli påvirket av dem. Kreftene er sterkere jo større masse atomene har.
Tabellen under viser halogenene sortert etter masse:
Forbindelse | Masse, u | ||
|---|---|---|---|
fluormolekyl | 38 | –220 | –188 |
klormolekyl | 71 | –101 | 35 |
brommolekyl | 160 | 7 | 59 |
jodmolekyl | 254 | 114 | 184 |
Fluor har lavt smelte- og kokepunkt, det vil si at det skal relativt lite energi til for å skille fluormolekyler fra hverandre.
Jod har høyt smelte- og kokepunkt. Det må derfor mye energi til for å få jod til å smelte eller koke, fordi det er nokså sterke krefter som virker mellom jodmolekylene.
Dette stemmer godt med at kreftene som virker mellom molekyler, er sterkere for atomer med stor masse enn for atomer med liten masse.
Jo større kontaktflate, jo sterkere krefter

Har du prøvd å åpne en stor borrelås? Da må du bruke ganske mye krefter! Det er mye lettere å åpne en borrelås med liten overflate. Der er det færre kroker som kan hekte seg inn i løkkene på motstykket.
Vi skal se at tilsvarende prinsipp gjelder for molekyler.
Stoffene under er alle bygd opp av 5 karbonatomer og 12 hydrogenatomer. De har altså lik masse. Til tross for dette har de ulike kokepunkter.
Når et stoff er i væskeform, er det krefter mellom molekylene som gjør at molekylene holder seg nokså samlet. Hvis vi øker temperaturen i væska, vil energien som tilføres, være stor nok til å dra molekylene fra hverandre.
Hvis kokepunktet til et stoff er lavt, er det et tegn på at kreftene mellom molekylene ikke er særlig sterke. Neopentan har det laveste kokepunktet av disse stoffene. Det betyr at kreftene som holder neopentanmolekylene sammen, er svakere enn kreftene som holder isopentanmolekylene sammen.
Forklaringen finner vi i overflata til stoffene. Neopentan er kuleformet og har derfor liten kontaktflate ut mot andre neopentanmolekyler. N-pentan er mer langstrakt. Det gir stor kontaktflate ut mot andre n-pentanmolekyler og større område der bindinger kan dannes.
Kreftene som virker mellom molekyler som er upolare, øker med
- massen til molekylene
- størrelsen på kontaktflata mellom molekylene
I et polart molekyl vil en del av molekylet ha en liten, positiv ladning, samtidig som en annen del har en liten, negativ ladning. Vi sier at molekylet er en dipol. HCl er et eksempel på et molekyl som er en (permanent) dipol.
Polare molekyler holdes sammen på grunn av tiltrekkende krefter mellom motsatte ladninger i molekyler som er i nærheten av hverandre.
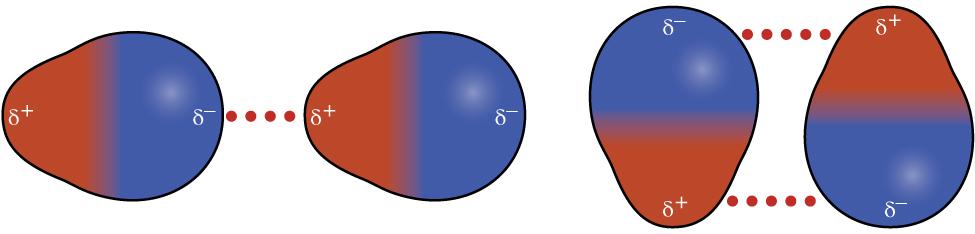
Disse kreftene er relativt mye sterkere enn kreftene mellom midlertidige dipoler. I tabellen under ser vi at kokepunktet til fluor er mye lavere enn kokepunktet til saltsyre. Det er altså lettere å få fluor til å koke enn å få saltsyre til å koke.
Forklaringen ligger i bindingene mellom molekylene: Fluormolekyler er midlertidige dipoler. Kreftene som virker mellom midlertidige dipoler, er mye svakere enn kreftene som virker mellom de permanente dipolene i HCl-molekyler.
Egenskap | HCl | F2 |
|---|---|---|
molekylvekt | 36,5 u | 38 u |
kokepunkt | –85 °C | –188 °C |
molekylet er en | permanent dipol | midlertidig dipol |