Fysiske eigenskapar blir bestemde av forma på molekyla

Kreftene som verkar mellom molekyl, er mykje svakare enn kreftene som verkar mellom atom, til dømes kovalente bindingar.
Det er vanleg å dele kreftene mellom molekyl inn i tre typar:
- krefter mellom upolare molekyl
- krefter mellom polare molekyl
- hydrogenbindingar
Elektron rører seg heile tida. Eit elektronpar som er delt likt mellom to hydrogenatom i H–H, kan derfor i ein liten augneblink vere nærare det eine H-atomet enn det andre.
Då oppstår det ein ladningsskilnad, og molekylet får ein negativ pol og ein positiv pol. I neste augneblink blir elektronparet trekt motsett veg, og ladninga i molekylet blir motsett av det ho var. Slik held det fram, og kva pol som er negativ og positiv, skiftar heile tida. Slike molekyl kallar vi mellombelse dipolar.
Denne mellombelse ladningsskilnaden gjer at upolare molekyl òg kan halde saman til ei viss grad. Dei tiltrekkande kreftene som oppstår, er derimot svake, og det skal lite til for å «rive» molekyla frå kvarandre.
Jo større masse, jo sterkare krefter
Krefter mellom mellombelse dipolar er svake, og molekyla må vere veldig nære kvarandre for å bli påverka av dei. Kreftene er sterkare jo større masse atoma har.
Tabellen under viser halogena sorterte etter masse:
Sambinding | Masse, u | ||
|---|---|---|---|
fluormolekyl | 38 | –220 | –188 |
klormolekyl | 71 | –101 | 35 |
brommolekyl | 160 | 7 | 59 |
jodmolekyl | 254 | 114 | 184 |
Fluor har lågt smelte- og kokepunkt, det vil seie at det skal relativt lite energi til for å skilje fluormolekyl frå kvarandre.
Jod har høgt smelte- og kokepunkt. Det må derfor mykje energi til for å få jod til å smelte eller koke, fordi det er nokså sterke krefter som verkar mellom jodmolekyla.
Dette stemmer godt med at kreftene som verkar mellom molekyl, er sterkare for atom med stor masse enn for atom med liten masse.
Jo større kontaktflate, jo sterkare krefter

Har du prøvd å opne ein stor borrelås? Då må du bruke ganske mykje krefter! Det er mykje lettare å opne ein borrelås med lita overflate. Der er det færre krokar som kan hekte seg inn i lykkjene på motstykket.
Vi skal sjå at tilsvarande prinsipp gjeld for molekyl.
Stoffa under er alle bygde opp av 5 karbonatom og 12 hydrogenatom. Dei har altså lik masse. Trass i dette har dei ulike kokepunkt.
Når eit stoff er i væskeform, er det krefter mellom molekyla som gjer at molekyla held seg nokså samla. Viss vi aukar temperaturen i væska, vil energien som blir tilført, vere stor nok til å dra molekyla frå kvarandre.
Om kokepunktet til eit stoff er lågt, er det eit teikn på at kreftene mellom molekyla ikkje er særleg sterke. Neopentan har det lågaste kokepunktet av desse stoffa. Det betyr at kreftene som held neopentanmolekyla saman, er svakare enn kreftene som held isopentanmolekyla saman.
Forklaringa finn vi i overflata til stoffa. Neopentan er kuleforma og har derfor lita kontaktflate ut mot andre neopentanmolekyl. N-pentan er meir langstrekt. Det gir stor kontaktflate ut mot andre n-pentanmolekyl og større område der bindingar kan dannast.
Kreftene som verkar mellom molekyl som er upolare, aukar med
- massen til molekyla
- storleiken på kontaktflata mellom molekyla
I eit polart molekyl vil ein del av molekylet ha ei lita, positiv ladning, samtidig som ein annan del har ei lita, negativ ladning. Vi seier at molekylet er ein dipol. HCl er eit døme på eit molekyl som er ein (permanent) dipol.
Polare molekyl blir haldne saman på grunn av tiltrekkande krefter mellom motsette ladningar i molekyl som er i nærleiken av kvarandre.
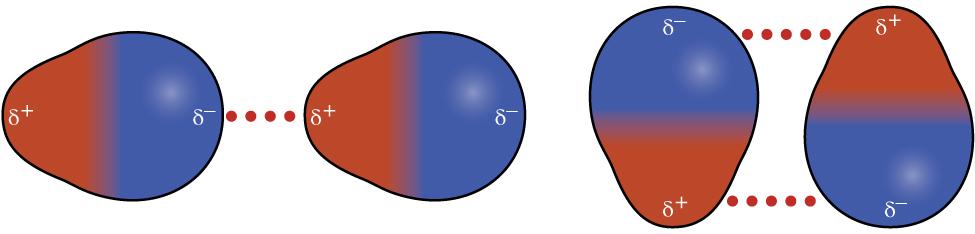
Desse kreftene er relativt mykje sterkare enn kreftene mellom mellombelse dipolar. I tabellen under ser vi at kokepunktet til fluor er mykje lågare enn kokepunktet til saltsyre. Det er altså lettare å få fluor til å koke enn å få saltsyre til å koke.
Forklaringa ligg i bindingane mellom molekyla: Fluormolekyl er mellombelse dipolar. Kreftene som verkar mellom mellombelse dipolar, er mykje svakare enn kreftene som verkar mellom dei permanente dipolane i HCl-molekyl.
Eigenskap | HCl | F2 |
|---|---|---|
molekylvekt | 36,5 u | 38 u |
kokepunkt | –85 °C | –188 °C |
molekylet er ein | permanent dipol | mellombels dipol |