Kokepunkt og krefter mellom molekyl
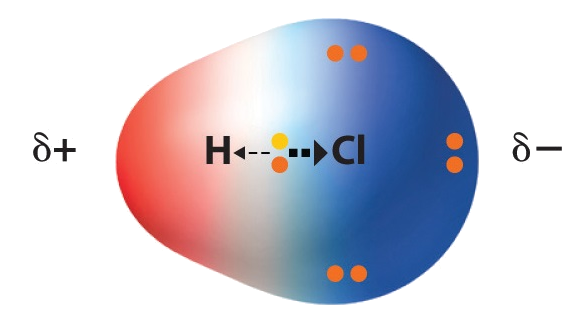
Atom i polare molekyl deler ikkje likt på elektrona. Molekyla kan dermed få ei ladning utetter.
Atom i ikkje-polare molekyl deler likt på elektrona. Slike molekyl har ikkje ei permanent ladning utetter. Sidan dei delte elektrona er i rørsle, oppstår det mellombelse ladningsskilnader i desse molekyla. Dette gjer at ikkje-polare molekyl òg kan bli tiltrekte av kvarandre.
Utforsk korleis det oppstår krefter mellom molekyla når dei er i nærleiken av kvarandre.
- Dra molekyla inntil kvarandre. Legg merke til kva som skjer.
- Prøv ut, og kombiner både like og ulike molekyl.
Sjølv om alle molekyl blir tiltrekte av kvarandre, er det ulike mønster og styrkar i tiltrekningskreftene.
Det er to typar tiltrekkingskrefter mellom molekyl:
- dipol–dipol
tiltrekkingskrefter mellom polare molekyl - ikkje-dipol–ikkje-dipol
tiltrekkingskrefter mellom upolare molekyl
Utforsk skilnaden i styrke for desse tiltrekkingskreftene med molekyl som er omtrent like store.
- Bruk nedtrekksmenyen til å velje molekyl du vil undersøkje.
- Dra i stjerna for å slite molekyla frå kvarandre.
Simuleringa viser molekyla i ein drope frå ei væske som er polar, og ein drope frå ei væske som er ikkje-polar. Når du varmar opp desse væskene, vil dei byrje å koke, slik at molekyla blir slitne frå kvarandre.
- Bruk knappane for å varme opp (eller avkjøle) væskene.
- Bestem omtrentleg temperatur for når dei to væskene byrjar å koke.
Dette er ei omarbeidd utgåve av Intermolecular Attractions and Boiling Point frå Concord Consortium.