Kovaleanta čanastat

Ii-metállat sáhttet čatnasit nubbi nubbái dan bokte ahte guovllut gos elektrovnnat lihkadit, badjálastet. Dainna lágiin sáhttet atomat juogadit elektrovnnaid ja seammás oláhit gávcci elektrovnna olggumus elektrovdnageardái.
Goappaš positiiva váibmosat gesset dan oktasaš elektrovdnabára lusaset, nu ahte atomat bissot ovttas. Mii dadjat ahte lea kemiijalaš čanastat atomaid gaskkas.
Kovaleanta čanastagaid sáhttá govvdit máŋgga ládje:
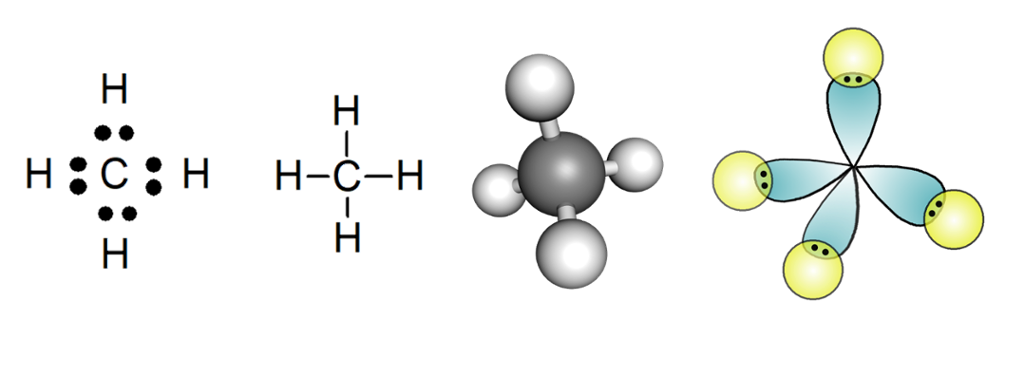
Elektrovdnačuokkisstruktuvrras geavahit mii vuođđoávdnasiid symbolaid ja govvidit čuoggáiguin juogaduvvon elektrovnnaid. Sáhcoformelii sárgut sázuid dan sadjái go čuoggáid. Kuvla-sággemodeallat addet buori gova molekyla geometriijas. Orbitálamodealla čajeha mo atomaid elektrovdnabalvvat muhtin molekylas badjálastet ja ávdnejit kovaleanta čanastagaid.
Jus atomat maid kovaleanta čanastat doallá oktii leat seammaláganat, de dat juogadit oktasaš elektrovnnaid dássedit atomaid gaskkas. Dat gusto ovdamearkka dihte hydrogenagássas, mas leat guokte hydrogenaatoma, .
Go iešguđetlágan atomat čatnasit oktii, de dat gesset elektrovnnaid lusaset iešguđet vuimmiin.
HCl-molekylas klora geassá elektrovnnaid lagabui go hydrogena. Sivvan dasá lea go klora lea eambbo elektronegatiiva atomasorta go hydrogena.
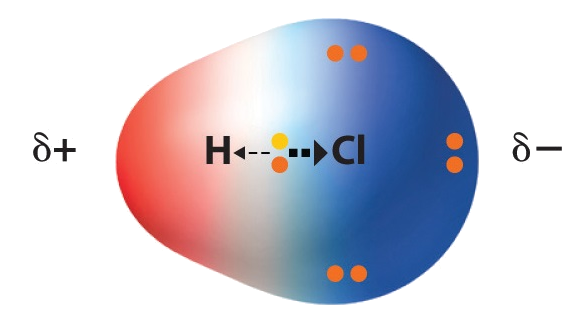
Čanastat gaskkal hydrogena ja klora gohčoduvvo polára kovaleanta čanastahkan. Mađi stuorát erohus lea oktiičadnon atomaid elektronegativitehtain, dađi eambbo ionalunddot lea čanastat.
Fuomáš ahte ii leat makkárge čielga erohusaid gaskkal sieiva kovaleanta čanastaga, polára kovaleanta čanastaga ja ionačanastaga.
Lávejit aŋkke bidjat rájiid daid iešguđet čanastatsorttaid gaskii, atomaid elektronegativitehta árvvuid vuođul.