Kokepunkter og krefter mellom molekyler
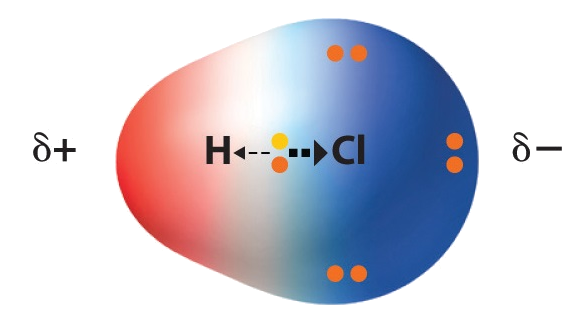
Atomer i polare molekyler deler ikke likt på elektronene. Molekylene kan dermed få en ladning utad.
Atomer i ikke-polare molekyler deler likt på elektronene. Slike molekyler har ikke en permanent ladning utad. Siden de delte elektronene er i bevegelse, oppstår det midlertidige ladningsforskjeller i disse molekylene. Dette gjør at ikke-polare molekyler også kan tiltrekkes av hverandre.
Utforsk hvordan det oppstår krefter mellom molekylene når de er i nærheten av hverandre.
- Dra molekylene inntil hverandre. Legg merke til hva som skjer.
- Prøv ut, og kombiner både like og ulike molekyler.
Selv om alle molekyler tiltrekkes av hverandre, er det ulike mønstre og styrker i tiltrekningskreftene.
Det er to typer tiltrekningskrefter mellom molekyler:
- dipol–dipol
tiltrekningskrefter mellom polare molekyler - ikke-dipol–ikke-dipol
tiltrekningskrefter mellom upolare molekyler
Utforsk forskjellen i styrke for disse tiltrekningskreftene med molekyler som er omtrent like store.
- Bruk nedtrekksmenyen til å velge molekyler du vil undersøke.
- Dra i stjerna for å slite molekylene fra hverandre.
Simuleringen viser molekylene i en dråpe fra en væske som er polar, og en dråpe fra en væske som er ikke-polar. Når du varmer opp disse væskene, vil de begynne å koke, slik at molekylene slites fra hverandre.
- Bruk knappene for å varme opp (eller avkjøle) væskene.
- Bestem omtrentlig temperatur for når de to væskene begynner å koke.
Dette er en bearbeidet utgave av Intermolecular Attractions and Boiling Point fra Concord Consortium.