Kovalent binding

Ikke-metaller kan binde seg til hverandre ved at områdene der elektronene beveger seg, overlapper hverandre. Slik kan atomene dele på elektroner og samtidig oppnå åtte elektroner i det ytterste elektronskallet sitt.
Hver av de positive kjernene trekker det felles elektronparet mot seg, slik at atomene holder sammen. Vi sier at det er en kjemisk binding mellom atomene.
Kovalente bindinger kan illustreres på flere måter:
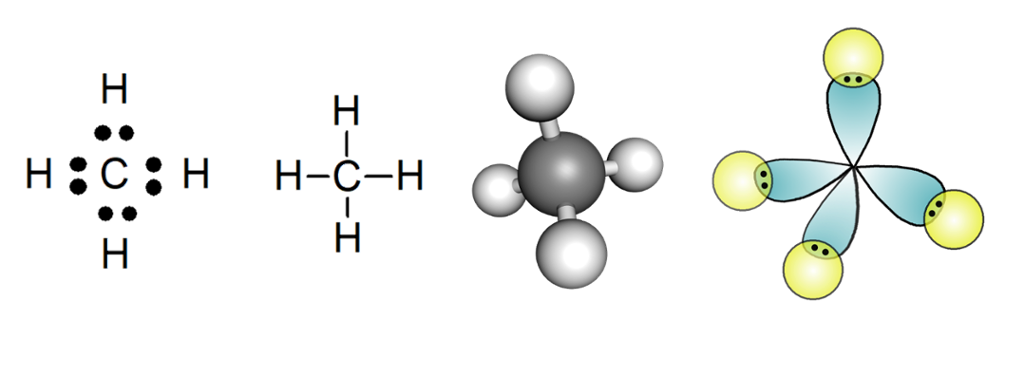
I en elektronprikkstruktur bruker vi grunnstoffsymbolene og illustrerer de delte elektronene med prikker. I en strekformel tegner vi streker i stedet for prikker. Kule-pinnemodeller gir et godt bilde av geometrien til et molekyl. En orbitalmodell viser hvordan elektronskyene til atomene i molekylet overlapper og danner kovalente bindinger.
Hvis atomene som holdes sammen av kovalent binding er av samme type, blir de felles elektronene delt likt mellom atomene. Det gjelder for eksempel i hydrogengass, som består av to hydrogenatomer, .
Når atomer av ulike typer binder seg sammen, vil de trekke de felles elektronene til seg i ulik grad.
I HCl-molekylet vil klor trekke elektronene nærmere seg enn det hydrogen vil gjøre. Det er fordi klor er en mer elektronegativ atomtype enn hydrogen.
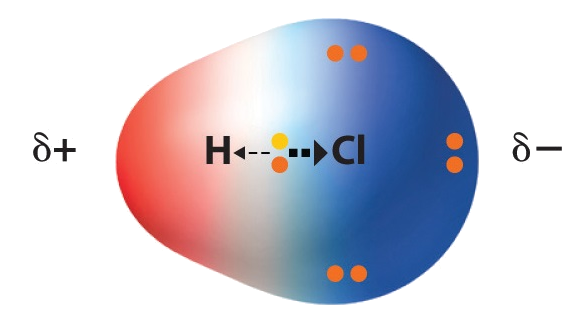
Bindingen mellom hydrogen og klor kalles en polar kovalent binding. Jo større forskjell det er på elektronegativiteten mellom atomene som er bundet sammen, jo større grad av ionekarakter har bindingen.
Legg merke til at det ikke er noe klart skille mellom ren kovalent binding, polar kovalent binding og ionebinding.
Til tross for dette setter man gjerne opp noen grenser for de ulike bindingstypene, basert på forskjellen i elektronegativitetsverdiene til atomene.