Laboratorieøvelse med brine
Den viktigste egenskapen til en kompletteringsvæske er densiteten, altså hvor mye den veier, målt i kg per liter. For å oppnå densiteten vi vil ha, tilsetter vi salt til ferskvann.
Type brine | Navn | Maks densitet utblandet | Tilsvarende vekt-% |
|---|---|---|---|
| KCl | kaliumklorid | 1,16 | 24 |
| NaCl | natriumklorid | 1,20 | 26 |
| NaBr | natriumbromid | 1,52 | 46 |
| CaCl2 | kalsiumklorid | 1,39 | 40 |
| CaBr2 | kalsiumbromid | 1,80 | 58 |
| NaCOOH | natriumformiat | 1,33 | 47 |
| KCOOH | kaliumformiat | 1,57 | 77 |
| CsCOOH | cesiumformiat | 2,30 | 83 |
Tabellen viser hvor høy densitet vi kan oppnå med hver enkelt salttype når vannet er mettet med saltet.
Det er også mulig å blande noen av saltene. På den måten oppnår vi løsninger med andre maksimale densiteter.
Type brine | sg utblandet |
|---|---|
NaCl/NaBr | 1,21–1,49 kg/l |
NaHCO2/KHCO2 | 1,34–1,57 kg/l |
CaCl2/CaBr2 | 1,40–1,81 kg/l |
CaBr2/ZnBr2 | 2,30 kg/l |
CaCl2/CaBr2/ZnBr2 | 1,84–2,29 kg/l |
Det er ikke nødvendig å regne ut hvor mye salt vi må tilsette vannet for å oppnå en bestemt densitet. Vi bruker heller brinetabeller, som i Drilling Data Handbook (DDH). Disse er basert på empiriske data, det vil si forsøk og erfaringer.
I kapittel H i DDH er det tabeller som viser ulike salter og deres egenskaper. Det er oppgitt hvor mye salt og vann som må blandes for å oppnå bestemte densiteter.
Hvis vi skal lage en kompletteringsvæske med en densitet på 1,16 kg/l, kan vi bruke en brinetabell for å gjøre noen valg. Vi ser da at kaliumklorid (potassium chloride) er det beste alternativet. Maksimum densitet med dette saltet er 1,16 kg/l, og det er et relativt billig salt.
I tabellen i DDH ser vi at for å oppnå 1 m3 løsning med densitet på 1,16 kg/l, må vi tilsette 279,6 kg KCl til 0,883 m3 ferskvann.
For å sjekke densiteten til væsken trenger vi et hydrometer, en beholder og et termometer. Er densiteten helt ukjent, kan vi bruke mudvekten (som vi bruker til å måle densiteten til borevæske) for å få et cirkabilde av densiteten.
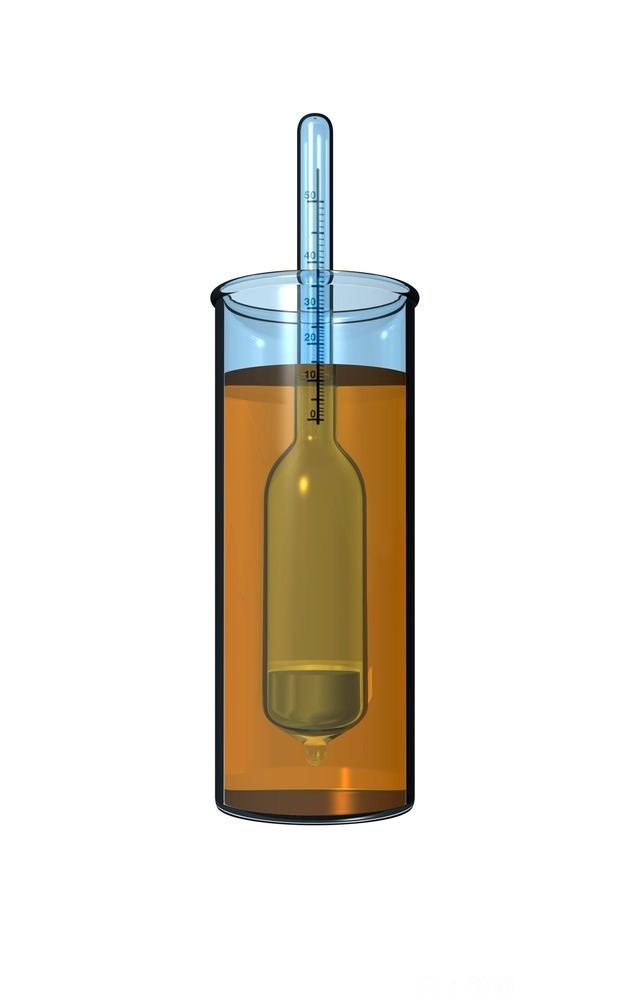
Et hydrometer er et instrument som måler den relative densiteten til væsker, det vil si forholdet mellom væskens densitet og densiteten til rent vann. Hydrometre lages med en avgrenset skala for ulike sammenhenger.
Et hydrometer er vanligvis lagd av glass og består av en stamme og en kolbe fylt med kvikksølv eller små blykuler. Væsken som skal testes, fylles i en beholder (sylinder) som er dyp nok. Hydrometeret senkes sakte ned i væsken helt til det (hydrometeret) flyter fritt.
Desto lavere densitet det er på væsken, jo lavere ned synker hydrometeret, basert på prinsippet for oppdrift.
Den spesifikke vekten leser vi av på en skala på stammen av hydrometeret, der overflaten til væsken ligger. Det er viktig at væskene er ved romtemperatur når vi skal lese av densiteten.
Vi har en brine med ukjent densitet. Væsken har en temperatur på 4 °C. Vi ønsker å finne nøyaktig densitet. Først må væsken varmes opp til romtemperatur. Vi måler densiteten i en mudvekt og ser at den er omtrent 1,40 sg. Vi må velge et hydrometer med rett skala.
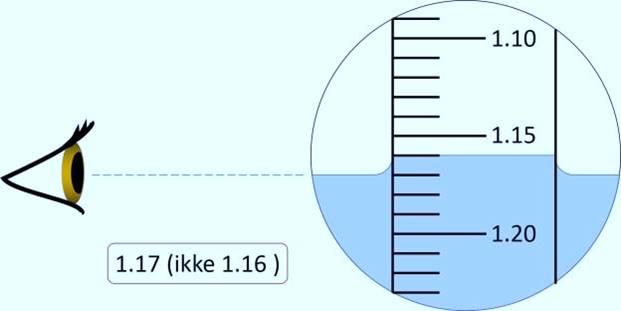
Så fyller vi væsken sakte i en litt stor sylinder. Vi må unngå dannelse av bobler i væsken. Hydrometeret senkes sakte ned i sylinderen helt til det flyter selv. Den nøyaktige densiteten på skalaen på stammen til hydrometeret leses av, og vi ser at den er 1,39 sg. Punktet for avlesning er der væskeoverflaten er, ikke der væsken går opp nær glassveggen.
Lag 1 liter saltløsning.
Bland vann med et salt fra laboratoriet (skolene har ulike samlinger med salt, velg fra lageret). Bruk en blandingstabell for å finne ut hvor mye salt og vann du skal blande. Husk temperaturen.
Sjekk densiteten ved hjelp av en mudvekt og et hydrometer.
Tilsett 100 ml rent vann. Sjekk densiteten på ny.
Bruk rapportgeneratoren over til å lage en refleksjon over øvelsen og hva du lærte om brine.
Related content
Kompletteringsvæsken erstatter boreslam i brønnen etter at borefasen er avsluttet, for å opprettholde den hydrostatiske trykkbalansen i brønnen.
Kompletteringsvæsker er saltløsninger som lages av rent vann blandet med salter som f.eks. kaliumklorid, natriumklorid, kalsiumklorid eller kalsiumbromid.