Åtte elektroner ytterst – stabil som en edelgass
Åtteregelen (eller oktettregelen) er en regel som sier at atomer er stabile med åtte elektroner i det ytterste skallet. Edelgassene (bortsett fra helium) har åtte elektroner i det ytterste skallet i utgangspunktet. Edelgassene er stabile, de reagerer i liten grad med andre atomtyper. Når et atom har åtte elektroner i det ytterste skallet, sier vi at det har edelgasstruktur.
Atomer som ikke allerede har åtte elektroner ytterst, vil prøve å oppnå dette ved å
dele elektroner med andre atomer
gi fra seg eller ta til seg elektroner
Åtteregelen sier at atomer er stabile med åtte elektroner i det ytterste skallet.
Dele elektroner
To ikke-metaller kan oppnå åtte elektroner i det ytterste skallet ved å dele på elektronpar mellom seg. Det delte elektronparet eies av begge atomene slik at begge "føler" at de har åtte elektroner i det ytterste skallet.
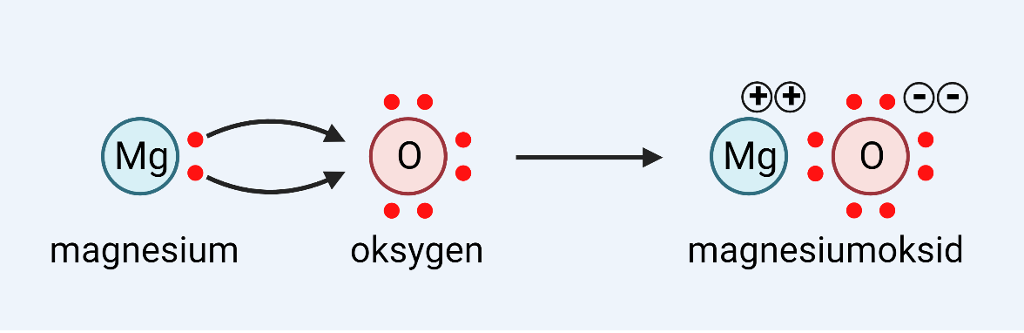
Gi fra seg eller ta til seg elektroner
Atomer kan oppnå åtte elektroner i det ytterste skallet ved å motta eller gi fra seg elektroner eller ved å dele elektroner. Dette skjer når et metall gir fra seg elektroner til et ikke-metall.
Elektronegativitet – atomene deler ikke likt på elektronene
Når atomer oppfyller åtteregelen ved å dele elektroner, er det ikke alltid de deler helt likt på elektronene.
Noen atomtyper trekker elektronene mer mot seg enn andre. Disse atomtypene har høyere elektronegativitet enn sin motpart.
Elektronegativitet er et mål på hvor stor evne et atom har til å tiltrekke seg elektroner i en binding.
Periodesystemet avslører elektronegativiteten
Periodesystemet under gir oversikt over hvor elektronegative de ulike grunnstoffene er. Fluor er det grunnstoffet som har høyest elektronegativitet, og det har fått verdien fire.
Selv om du ikke har oppgitt elektronegativitetsverdiene, kan du bruke grunnstoffenes plassering i periodesystemet til å vurdere stoffer opp mot hverandre.
Oppgave
Studer figuren og se om du finner hvilken trend verdiene følger.
Hva er systemet med elektronegativiteten?
Elektronegativiteten øker på skrå oppover mot høyre
Når elektronegativiteten øker, betyr det at evnen til å trekke på elektroner i en binding blir større. I figuren over ser vi at elektronegativitetsverdiene øker når vi beveger oss fra nederst til venstre og på skrå oppover mot høyre.
Forklaringen på dette er todelt:
Når vi beveger oss bortover en periode, øker antall protoner i kjernen. Da øker tiltrekningskraften mellom kjernen og bindingselektronene.
Etter hvert som vi beveger oss oppover i ei gruppe, vil elektronene i de ytterste skallene befinne seg nærmere den positivt ladde kjernen. Atomkjernen til disse stoffene vil dermed trekke sterkere på elektroner i ei binding enn stoffer lenger ned i gruppa.
Kilde
Pedersen, B. (2018, 30. november). Oktettregelen. I Store norske leksikon. https://snl.no/oktettregelen